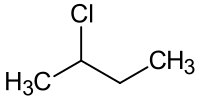
2-氯丁烷
外觀
| 2-氯丁烷 | |
|---|---|
| |
| 別名 | 氯代仲丁烷 仲丁基氯 |
| 識別 | |
| CAS號 | 78-86-4 22157-31-9((R)) 22156-91-8((S)) |
| PubChem | 6563 23616278((R)) 637146((S)) |
| ChemSpider | 6315, 19952591 (R), 552795 (S) |
| SMILES |
|
| InChI |
|
| InChIKey | BSPCSKHALVHRSR-UHFFFAOYSA-N |
| EINECS | 201-151-7 |
| ChEBI | 166855 |
| 性質 | |
| 化學式 | C4H9Cl |
| 摩爾質量 | 92.57 g·mol−1 |
| 密度 | 0.873 g·cm−3 |
| 熔點 | -140 °C(133 K) |
| 沸點 | 68 °C(341 K) |
| 磁化率 | -67.40·10−6 cm3/mol |
| 危險性 | |
GHS危險性符號 
| |
| GHS提示詞 | Danger |
| H-術語 | H225, H315, H319, H335 |
| P-術語 | P210, P233, P240, P241, P242, P243, P261, P264, P271, P280, P302+352, P303+361+353, P304+340, P305+351+338 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
2-氯丁烷是一種有機氯化合物,化學式為C4H9Cl。它是無色揮發性液體,有鹵代烴的氣味。 它可由2-丁醇在氯化鋅的存在下和濃鹽酸反應得到,[1]此外,在三苯基膦的存在下,四氯化碳也可作為氯化試劑,將2-丁醇轉化為2-氯丁烷。[2]它和疊氮化鈉在二甲基甲酰胺中反應,可以得到2-疊氮基丁烷。[3]它和鎂在乙醚中反應,可以得到2-丁基氯化鎂[4];和鋰反應,得到2-丁基鋰。[5]
參考文獻
[編輯]- ^ Arthur I. Vogel. 169. Physical properties and chemical constitution. Part VIII. Alkyl chlorides, bromides, and iodides. Journal of the Chemical Society (Resumed). 1943: 636 [2021-01-18]. ISSN 0368-1769. doi:10.1039/jr9430000636 (英語).
- ^ Bertrand R. Castro. John Wiley & Sons, Inc. , 編. Replacement of Alcoholic Hydroxyl Groups by Halogens and Other Nucleophiles via Oxyphosphonium Intermediates. Hoboken, NJ, USA: John Wiley & Sons, Inc. 1983-07-27: 1–162 [2021-01-18]. ISBN 9780471264187. doi:10.1002/0471264180.or029.01 (英語).
- ^ Kishore Kumar Angajala, Sunitha Vianala, Ramesh Macha, M. Raghavender, Murali Krishna Thupurani, P. J. Pathi. Synthesis, anti-inflammatory, bactericidal activities and docking studies of novel 1,2,3-triazoles derived from ibuprofen using click chemistry. SpringerPlus. 2016-12, 5 (1) [2021-01-18]. ISSN 2193-1801. doi:10.1186/s40064-016-2052-5. (原始內容存檔於2018-06-02) (英語).
- ^ O. G. Yarosh, M. G. Voronkov, L. V. Zhilitskaya, N. O. Yarosh, A. I. Albanov, I. M. Korotaeva. Organomagnesium Synthesis of sec-Butyl- and tert-Alkylchlorogermanes and Their Reaction with Ethynylmagnesium Bromide. Russian Journal of General Chemistry. 2005-05, 75 (5): 714–718 [2021-01-18]. ISSN 1070-3632. doi:10.1007/s11176-005-0305-z (英語).
- ^ Dieter, R. Karl. Product subclass 1: Lithium metal. Science of Synthesis, 2006. 8a. 43-132. CODEN: SSCYJ9.
