卡羅爾重排反應
外觀
(重新導向自Carroll反应)
卡羅爾重排反應(英語:Carroll rearrangement),又稱卡羅爾-克萊森重排反應,指β-酮酸烯丙酯發生克萊森重排反應產生α-烯丙基-β-酮酸,再經脫羧,得到γ,δ-不飽和酮。[1]
反應機理
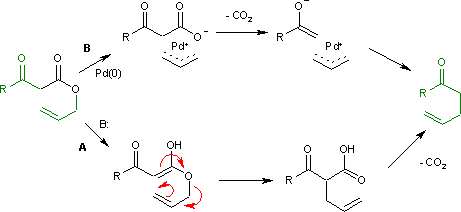
[編輯]反應最初是用鹼催化,採用一鍋反應,即酯交換(製取β-酮酯)-卡羅爾重排串聯進行,需要苛刻條件(乙酸鈉,170-240℃)。其機理為烯醇發生的克萊森重排然後脫羧(下圖A途徑)。現多採用分步方法進行,主要改進包括雙負離子法(用二異丙基氨基鋰生成雙負離子,然後在室溫或回流下重排,由此得到的酮酸較易分離)[2][3]以及負載在氯化鋁上無溶劑條件下的反應[4]。
1980年辻二郎對此反應作了改進,他用鈀(0)作催化劑,經過生成中間體烯丙基正離子/羧酸根負離子有機金屬配合物,然後脫羧和烯丙基化,實現了溫和條件下的卡羅爾重排(下圖B途徑)。[5]
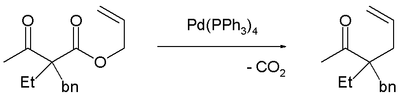
下面用四(三苯基膦)鈀(0)催化的實驗證實了脫羧一步是在烯丙化前發生。[6]
不對稱脫羧烯丙化反應
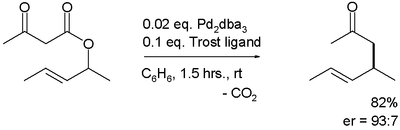
[編輯]使用手性配體的不對稱卡羅爾重排也有發展。[7] 首個不對稱重排由 Burger 等在 2004 年報道,是以三(二亞苄基丙酮)二鈀(0)和Trost配體催化:[6]
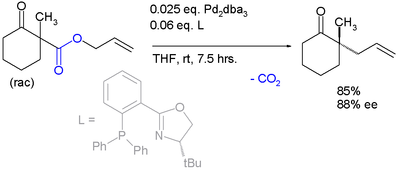
桑野良一等報道了萘酚存在下的卡羅爾重排,反應ee可達88%,但缺點是底物必須要含乙酰氨基基團。[8]

不對稱卡羅爾重排也可拓展至烯醇的碳酸酯發生的α-烯丙基化。[10]

參見
[編輯]參考資料
[編輯]- ^ Carroll, M. F. 131. Addition of α,β-unsaturated alcohols to the active methylene group. Part I. The action of ethyl acetoacetate on linalool and geraniol. J. Chem. Soc. 1940: 704–706. doi:10.1039/JR9400000704.
- ^ J. F. Genus, D. D. Peters, J-F. Ding, T. A. Bryson. The Dianion Carroll Rearrangement - A Cyclic Application. Synlett. 1994: 209–210. doi:10.1055/s-1994-22797.
- ^ Stephen R. Wilson, Martyn F. Price. The ester enolate Carroll rearrangement. J. Org. Chem. 1984, 49 (4): 722–725. doi:10.1021/jo00178a036.
- ^ S. I. Pogrebnoi, Y. B. Kalyan, M. Z. Krimer, W. A. Smit. Carrol rearrangement on the surface of chromatographic grade alumina. Tetrahedron Lett. 1987, 28 (41): 4893–4896. doi:10.1016/S0040-4039(00)96654-1.
- ^ Isao Shimizu, Toshiro Yamada and Jiro Tsuji. Palladium-catalyzed rearrangement of allylic esters of acetoacetic acid to give γ,δ-unsaturated methyl ketones. Tetrahedron Letters. 1980, 21 (33): 3199–3202. doi:10.1016/S0040-4039(00)77444-2.
- ^ 6.0 6.1 Erin C. Burger and Jon A. Tunge. Asymmetric Allylic Alkylation of Ketone Enolates: An Asymmetric Claisen Surrogate. Org. Lett. 2004, 6 (22): 4113–4115. doi:10.1021/ol048149t.
- ^ Shu-Li You and Li-Xin Dai. Enantioselective Palladium-Catalyzed Decarboxylative Allylic Alkylations. Angew. Chem. Int. Ed. 2006, 45 (32): 5246–5248. doi:10.1002/anie.200601889.
- ^ Kuwano, R.; Ishida N.; Murakami, M. Asymmetric Carroll rearrangement of allyl α-acetamido-β-ketocarboxylates catalysed by a chiral palladium complex. Chem. Commun. 2005, (31): 3951–3952. doi:10.1039/b505105c..
- ^ Justin T. Mohr, Douglas C. Behenna, Andrew M. Harned, and Brian M. Stoltz. Deracemization of Quaternary Stereocenters by Pd-Catalyzed Enantioconvergent Decarboxylative Allylation of Racemic β-Ketoesters. Angew. Chem. Int. Ed. 2005, 44 (42): 6924–6927. doi:10.1002/anie.200502018.
- ^ Barry M. Trost and Jiayi Xu. Palladium-Catalyzed Asymmetric Allylic α-Alkylation of Acyclic Ketones. J. Am. Chem. Soc. 2005, 127 (49): 17180–17181. doi:10.1021/ja055968f.
