氧化態
氧化態(英文:Oxidation State)表示一個化合物中某個原子的氧化程度。形式氧化態是通過假設所有異核化學鍵都為100%離子鍵而算出來的。氧化態用阿拉伯數字表示,可以為正數、負數或是零。
氧化態的升高稱為氧化,降低則稱為還原。這兩個過程涉及電子的形式轉移,即總體上看,還原是獲得電子的過程,而氧化是失去電子的過程。
「氧化態:一種化學物質中某個原子氧化程度的量度。根據以下公認的規則可計算該原子的電荷:
形式氧化態的計算
[編輯]有兩種方法可以計算化合物中某原子的氧化態。第一種方法適用於容易畫出路易斯結構的分子,通常情況下為有機分子;而第二種方法不需要路易斯結構,也不必為分子,適用於較簡單的化合物。
需要注意的是,一個原子的氧化態並不等於這個原子的實際電荷。尤其對於高氧化態的原子而言,其生成高價陽離子的電離能可能要比化學反應中實際的能量高出很多。原子之間氧化態的分配純粹是形式上的。這種方法有助於理解化學反應的機理。
從路易斯結構計算
[編輯]當一個分子的路易斯結構可以被畫出來時,很明顯氧化態可通過比較中性原子的價電子數和路易斯結構中該原子所擁有的電子數來計算。為了計算,異核化學鍵的成鍵電子歸屬於電負性較強的原子;同核化學鍵的成鍵電子在兩個原子間平等分配;而孤對電子則歸屬於其相應含有孤對電子的原子。
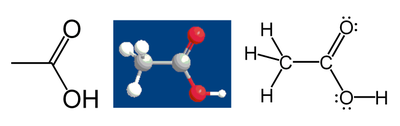
例如,對於乙酸:
由於碳電負性高於氫,因此甲基中的碳原子可以從三個氫原子「得到」6個價電子。同理,由於是同核化學鍵,因而這個碳原子在 C-C 鍵中獲得1個價電子。加上前面的6個則總共有7個價電子。中性碳原子有4個價電子(碳位於第4族),因此甲基碳的氧化態為 4 - 7 = -3(C3−),當然這是在假設所有鍵都是離子鍵的前提下得出的。
使用相同的規則可以得出,羧基中碳原子的氧化態為+3。具體過程為:C-C 鍵中碳原子分得一個價電子;C=O 鍵和 C-O 鍵中,由於氧電負性大於碳,因此所有的成鍵電子都歸屬於氧。中性碳原子的4個價電子減去1個價電子即得到+3氧化態。而所有氧原子的氧化態則為-2(6-[(4+4)+2]),所有氫原子的氧化態都為+1。
氧化態可被用於氧化還原反應方程式的配平,因為氧化反應和還原反應中電子轉移是相等的。例如:在托倫試劑(銀氨溶液)氧化乙醛為乙酸的反應中,羰基碳原子的氧化態由+1變為+3,而銀原子的氧化態則由+1變為0。因此配平時需要2mol的銀離子:
不用路易斯結構計算
[編輯]- 中性分子中各原子氧化態的代數和必須為零,而離子中各原子氧化態的代數和與離子電荷相等。
- 一些元素具有特定的氧化態。
以上兩點可用來計算較簡單的化合物中各原子的氧化態。相應的規則有:
- 氟在其所有的化合物中都呈現-1氧化態,因為其電負性在所有元素中是最強的。
- 當氟以外的鹵素與氧、氮、或其他氟以外的鹵素結合時,其氧化態為-1。例如,在溴化氯(或氯化溴)(BrCl)中,氯的氧化態為-1。然而,一氟化氯(ClF)中的氯的氧化態,根據上一條規則,由於氟電負性在所有元素中是最強的,因此氟要優先決定,則氯的氧化態為+1。
- 除非與更加電正性的元素如鈉、硼和鋁相連,氫總是呈現+1氧化態。呈-1氧化態的例子有 NaH、LiAlH4 和 NaBH4 等。
- 氧一般為-2氧化態,除了過氧化物中為-1,超氧化物中為-1/2,臭氧化物中為-1/3,OF2 中為+2,O2F2 中為+1。
- 鹼金屬幾乎任何時候都為+1氧化態,例外是鹼化物。
- 鹼土金屬在多數情況下都為+2氧化態。
例如:根據以上規則,在 Cr(OH)3 中,氧為-2氧化態,氫為+1,因此三個氫氧根的氧化態和為-3。因而 Cr 的氧化態為+3。
具有多氧化態的元素
[編輯]大多數元素都具有可變的氧化態,例如碳可有九種:
氧有八種氧化態:
- -2 多數氧化物中,如 ZnO,CO2,H2O
- -1 所有過氧化物中
- -1/2 超氧化物中,如 KO2
- -1/3 臭氧化物中,如 NH4O3
- 0 單質氧氣中 O2
- +1/2 二氧基鹽中,如 O2PtF6
- +1 O2F2 中
- +2 OF2 中
分數氧化態
[編輯]從路易斯結構求得的形式氧化態總是整數,但不從路易斯結構求時,為了表示化合物中幾個原子的平均氧化態,有可能得到某原子的分數氧化態。例如 KO2 中,兩個氧原子的氧化態則分別為0和-1,而氧原子的平均氧化態為分數(-1/2)。在有些情況中,由於共振,幾個原子可能是等同的。這種情況下一個路易斯結構式無法表示其真實結構,必須要用多個結構來表示。
氧化數
[編輯]氧化態和氧化數常常不加區分地使用,但在配位化學中,兩者是有區別的。計算氧化數時,不考慮電負性差異,認為成配位鍵的電子為配體佔有。此外,氧化數用羅馬數字表示,但氧化態用阿拉伯數字表示。
歷史
[編輯]1938年,W. M. Latimer 首先引入了氧化態的概念。氧化則是由拉瓦錫提出的:他認為氧化是元素與氧化合的過程,產物是任何含氧的鹽類。[2]
參見
[編輯]參考資料
[編輯]- ^ IUPAC Gold Book (PDF). [2008-03-07]. (原始內容存檔於2016-03-30).
- ^ The Origin of the Oxidation-State Concept William B. Jensen J. Chem. Educ. 2007, 84, 1418.