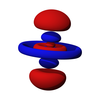
g軌域

在化學與原子物理學中,g軌域(英語:g orbital)是一種原子軌域,其角量子數為4,其磁量子數可以為0、±1、±2、±3、±4,且每個殼層裏中有9個g軌域,gz4、gxz3、gyz3、gxyz2、gz2(x2-y2)、gx3z、gy3z、gx4+y4、gxy(x2-y2)[1],有三種形狀,且方向不同,每個可以容納2個電子,因此,g軌域共可以容納18個電子。
由於目前尚未發現第八週期元素,因此在已知的元素中,g軌域只存在於激發態的原子中。
命名
[編輯]結構
[編輯]g軌域從主量子數n=5時開始出現,由於主量子數不能小於5,因此最小的g軌域是5g軌域,且不存在1g、2g、3g和4g軌域。當角量子數=5時,對應於9個磁量子數:4、3、2、1、0、-1、-2、-3、-4。每個殼層皆有9個g軌域,分別為gz4、gxz3、gyz3、gxyz2、gz2(x2-y2)、gx3z、gy3z、gx4+y4、gxy(x2-y2),有三種形狀,其中磁量子數m = ±1或±4時(gxz3、gyz3、gx4+y4、gxy(x2-y2))形狀相同但方向不同為八片豆子形;磁量子數m = ±2或±3時(gxyz2、gz2(x2-y2)、gx3z、gy3z)形狀相同但方向不同為為十二葉啞鈴形;而磁量子數m = 0時(gz4)的形狀較特別,類似於dz2軌域,但中間的環的上下多了一個類似碗的形狀,其開口朝向上下的啞鈴形。
g區元素
[編輯]g區元素是指元素週期表中新增加的電子是填在g軌域上的元素。這一區的所有元素目前均尚未被發現。預測週期表中從第8週期開始的每個週期都各將有18個g區元素。
g之後的軌域
[編輯]g之後的軌域目前尚未觀測到,但根據計算結果是有可能存在的。其命名則依字母順序命名,除了不與s軌域和p軌域的s、p重複之外,另外還跳過j這個字母[2](由於某些語言不分i與j),因此沒有任何軌域會以「j軌域」來命名。
h軌域
[編輯]
目前還沒有發現h軌域 ,但根據現有理論,h軌域(英語:h orbital)是一種原子軌域,其角量子數為5,其磁量子數可以為0、±1、±2、±3、±4、±5,且每個殼層裏中有11個h軌域,其形狀可由薛定諤方程式來預測。
具有最高能量的電子是填在h軌域上的元素稱為h區元素,位於第九週期之後,許多目前的物理模型都崩潰了或不適用,因此可能無法存在。
i軌域
[編輯]目前還沒有發現i軌域 ,但根據現有理論,i軌域(英語:i orbital)是一種原子軌域,其角量子數為6,其磁量子數可以為0、±1、±2、±3、±4、±5、±6,且每個殼層裏中有13個i軌域,其形狀可由薛定諤方程式來預測。
i軌域從主量子數n=7時開始出現,由於主量子數不能小於7,因此最小的f軌域是7i軌域,但由於能階交錯,會從第9週期或第10週期後才開始填入,根據Pyykkö模型,其原子序將超過173,當前考慮到核電荷分佈之有限延伸的計算,結果約等於173(unseptrium),非離子原子所屬的元素可能僅限於等於或低於這個結果[3]
玻爾模型在原子序達到137之後會有問題,因爲在1s原子軌域中的電子的速度v計算如下:
當中Z是原子序,α是描述電磁力強度的精細結構常數。[4]如此一來,任何原子序高於137的元素的1s軌域電子將會以高於光速c運行,物理上不可能。因此任何不建基於相對論的理論(如波爾模型)不足以處理這種計算。
半相對論的狄拉克方程式在原子序大於Uts時也會發生問題,因爲基態能階為:
當中m0是電子的靜質量。而當原子序大於137,狄拉克基態的波函數是震蕩的,並且正能譜與負能譜之間沒有間隙,正如克萊因悖論所言。[5]理查德·費曼(Richard Feynman)指出了這效應。
然而,現實的計算已考慮到了核電荷分佈的有限延伸。約等於173(Unseptrium)的臨界的Z使得非離子原子所屬的元素可能僅限於等於或低於這個結果,因此,電子可能無法填至i軌域,因此i軌域有可能根本不存在。
k軌域
[編輯]k軌域是根據軌域命名規則照字母順序跳過「j」[2][6]所得到的軌域名稱,因此當角量子數為7時,不會是j軌域,而是k軌域,由於i軌域可能不存在,因此,k軌域僅是原子軌域模型的理論值。
參見
[編輯]參考文獻
[編輯]- ^ Chemical-Bonding-and-Organic-Chemistry. docstoc.com. [2013-05-26].
- ^ 2.0 2.1 2.2 Griffiths, David. Introduction to Quantum Mechanics. Prentice Hall. 1995: 190–191. ISBN 0-13-124405-1.
- ^ Walter Greiner and Stefan Schramm, Am. J. Phys. 76, 509 (2008), and references therein.
- ^ See for example R. Eisberg and R. Resnick, Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles, Wiley (New York: 1985).
- ^ James D. Bjorken and Sidney D. Drell, Relativistic Quantum Mechanics, McGraw-Hill (New York:1964).
- ^ Levine, Ira. Quantum Chemistry 5. Prentice Hall. 2000: 144–145. ISBN 0-13-685512-1.
- 曾國輝《原子結構》建宏出版社 台北市 1999 ISBN 957-724-801-2
| |||||||||||||||||||||||||||||||