乙烯基環丙烷重排反應
乙烯基環丙烷重排(英文:vinylcyclopropane rearrangement,或稱乙烯基環丙烷-環戊烯重排)是將乙烯基取代的環丙烷變為環戊烯的擴環反應[1][2][3]。

實驗性與計算性研究表明,乙烯基環丙烷重排反應的機理被認為是雙自由基介導的兩步過程和/或軌道對稱性控制的周環過程,兩種機理在具體反應中起的作用主要取決於底物。
由於能用於構建環戊烯環,乙烯基環丙烷重排反應已被用於合成複雜天然產物中的關鍵步驟。
歷史[編輯]
1959年,一位從西北大學畢業的年輕化學博士Norman P. Neureiter,受僱於亨博爾石油公司(現為Exxon),被指派去研究煉油過程中產生的過量丁二烯的新型用途。他與公司內最權威的顧問——耶魯大學教授William von Eggers Doering討論了卡賓化學,在其引導下,他們根據兩年前發表的一篇二鹵卡賓和丁二烯加成反應的研究[4]和Doering之前對二氯卡賓加成反應的研究[5],將得到的1,1-二氯-2-乙烯基環丙烷加熱分解(大於400℃),發現該物質重排為4,4-二氯環戊烯,該反應被認為是世界上第一個乙烯基環丙烷-環戊烯重排反應[6]。

在該報告發表一年後,Emanuel Vogel [7]和Overberger[8][9]分別獨立報告了相應的全碳乙烯基環丙烷重排反應。雖然Doering仍受僱於亨博爾石油公司,並且作為Neureiter研究的顧問,他依然在1963年發表的一份出版物中提出:「發現乙烯基環丙烷重排為環戊烯的反應要歸功於Overberger和Borchert,以及Vogel等人,他們似乎已經獨立發現了幾個重排的實例。」[10]後續乙烯基環丙烷衍生物的重排反應進展很順利,如Atkinson和Rees在1967年[11]、Lwowski在1968年[12]和Paladini與Chuche在1971年[13]的研究。
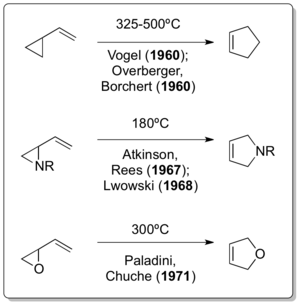
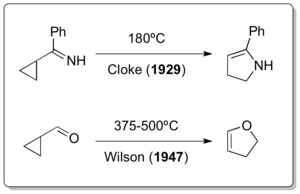
奇特的是,在經典的乙烯基環丙烷重排反應被發現的30年和12年之前,它的兩個雜原子衍生物擴環反應就已經被人們所知曉。儘管當時人們認為乙烯基環丙基重排只發生在1922年Nikolay Demyanov通過霍夫曼消除在高溫下製備乙烯基環丙烷的過程[14]中,但Cloke[15]在1929年的2-吡咯啉重排反應和Wilson[16]在1947年的2,3-二氫呋喃重排反應都是類似乙烯基環丙烷重排的反應。這兩個反應後來被稱為 Cloke-Wilson重排反應。
機理[編輯]
關於乙烯基環丙烷重排反應進行的機理,是由雙自由基介導的兩步過程,還是由軌道對稱性控制的協同過程,已經進行了超過半個世紀的討論。動力學數據及在乙烯基末端觀察到的二級同位素效應表明這是一個協同反應,然而產物的空間異構體又表現出分步的雙自由基機理[17]。
在1960年代,即該重排被發現後不久,就確定了反應活化能約為50 kcal/mol [18]。該重排反應的動力學數據與協同反應機理一致,其中環丙基C-C鍵的斷裂是決速步。然而隨後發現打開環丙烷中C-C鍵所需的活化能為63 kcal/mol [19]比乙烯基環丙烷的活化能高出13 kcal/mol,明顯地近似於烯丙基自由基的共振能量[20]。人們於是認識到在加熱條件下弱C1-C2鍵均裂產生雙自由基型中間體的可能性。

關於乙烯基環丙烷重排反應究竟是通過完全協同還是兩步、非協同的機理的進一步討論,伍德沃德和羅德·霍夫曼在1969年解釋[1,3]-σ遷移反應的烷基轉移過程中,以該反應舉例進行了詳細地討論[21]。他們假設反應機理是協同的,根據分子軌道對稱守恆原理將只能產生某些特定空間結構的產物。他們分析了三個取代基的乙烯基環丙烷重排產物,保留C2構象的C1-C2鍵向C5的異面[1,3]-遷移和反轉C2構象的C1-C2鍵向C5的同面[1,3]-遷移得到的產物ar和si是對稱性允許的。而保留C2構象的C1-C2鍵向C5的同面[1,3]-遷移和反轉C2構象的C1-C2鍵向C5的異面[1,3]-遷移得到的產物sr和ai是對稱性禁阻的。伍德沃德和霍夫曼的分析僅僅基於軌道對稱性守恆的原理,而沒有進行任何機械性或立體化學的預測。

伍德沃德和霍夫曼的討論為判斷機理是協同或是分步的提供了基礎,人們可以通過對反應產物的立體化學模型,觀察sr和ai的產物存在便可以判斷機理。事實上,找到合適的取代物模型來研究該重排反應產物的立體化學結構比想像中更加困難,因為副反應如同二烯基[1,5]-氫遷移,而熱立體變更[註 1]更是比重排更快地擾亂產物的立體結構差異。

儘管重排反應背後複雜的動力學場景的解卷積很困難,依然有一些關於其動力學和立體化學原始數據的精準、明確的解卷積來支撐立體變更對產物立體空間結構的競爭性影響[17][22][23][24]。
從而確定了乙烯基環丙烷重排反應四種途徑的反應速率常數:

數據上可以看出,產物結構的分佈受底物影響。反式乙烯基環丙烷傾向於產生對稱性允許的ar和si型產物,支持協同機理。順式乙烯基環丙烷則傾向於產生對稱性禁阻的ai和sr產物,自由基機理更佔上風。從數據中也可以看到取代基對立體化學的影響,有增加自由基穩定性的取代基不僅降低了重排反應活化能,而且相對於環戊烯形成的速率,最初產生的雙自由基物質的重新閉合變得更慢,進而導致了總體上更協同的機理和更少的立體變更影響。在所有情況中,都產生了四種產物,證明兩種機理可能並行存在。
發展[編輯]
乙烯基環丙烷重排作為一種實用有機合成方法而言,最大的缺點是反應的高活化能壘導致其需要非常高的反應溫度(約500-600℃)。在如此高溫下,不僅會產生許多副反應(如[1,5]-氫遷移),還嚴格限制了底物中可以存在的官能團。為了使該反應能用於天然產物合成,必須對該反應本身進行改進。
以下列出在特定環境中有更溫和反應條件的方法: Corey小組[25]在1972年首次嘗試以乙烯基環丙烷重排作為一種合成方法進行改進。他們發現當環丙烷中含有二硫己環時,反應所需的溫度會顯著降低。雖然二硫己環取代乙烯基環丙烷底物需要從對應的1,3-二烯開始兩步合成,該方法已被證明可以用於合成取代環戊烯,重排產物容易轉化為環戊烯酮。

一年後,Simpson等人[26]使用簡單的甲氧基取代乙烯基環丙烷在220℃完成了重排,並且擁有更快的反應速率。

在1970年代中期,Barry M. Trost的小組取得了重要的進展,他們發現矽氧烷基乙烯基環丙烷[27]及相似的苯基乙烯環丙烷基硫醚[28]可以用於構建環戊烯結構,這些反應依然需要超過300℃的反應溫度。

Paquette等人[29][30]證明了乙烯基環丙烷的重排可以通過光化學途徑進行。

Hudlicky[31]和Brown[32]證明了該重排反應可以使用過渡金屬催化劑,使用Rh(I)-乙酰丙酮催化劑使反應溫度進一步降低到了20-80℃。

1980年,Danheiser[33]提出了一種由烷氧基陰離子加速的反應,類似Cope重排的乙烯基環丙烷重排反應。

1988年,Larsen[34]報告了一種在-78℃的低溫下進行乙烯基環丙烷重排的研究。該反應的底物是在鹼性條件下通過硫代羰基Diels-Alder反應加合產物的原位上產生的,這種方法發生的重排反應可以高空間選擇性的構建多種官能團。

Hudlicky小組[35]報告了另一種低溫乙烯基環丙烷重排反應,這種方法可以用於合成各種橋環化合物。

全合成[編輯]
戊環是天然產物中普遍存在的結構,基於Diels-Alder反應可以通過簡單原料來構建複雜的己環框架,而戊環的結構上的「不協調性」限制了通過該反應一步構建骨架。在1960年代的乙烯基環丙烷重排發現後,其作為構建天然產物中環戊烯支架的方法在後續70年代得到了改進,至80年代第一個利用乙烯基環丙烷重排的全合成出現,以Barry M. Trost、Elias J. Corey、Thomas Hudlicky和Leo A. Paquette為代表的天然產物合成方法開始被報道。
合成艾菲地可寧[編輯]
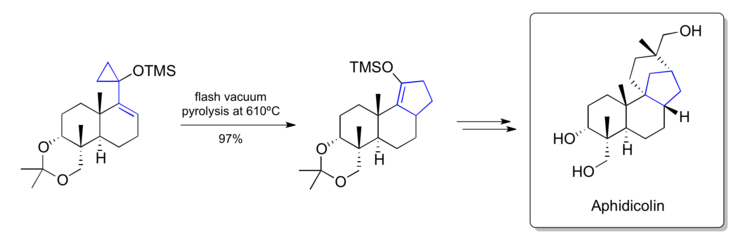
在1979年,Trost報道了乙烯基環丙烷重排合成艾菲地可寧的研究[36]。在其中一步中,他們將矽氧烷基取代的乙烯基環丙烷結構通過真空閃熱解轉化為環戊烯結構。
合成客烯[編輯]
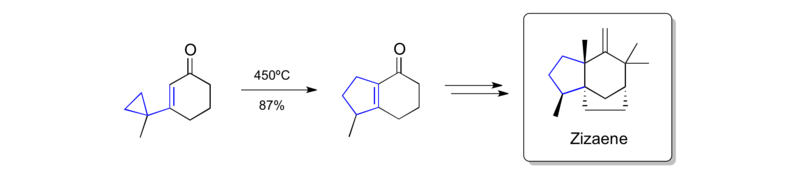
Piers在早期合成(±)-客烯[註 2]時使用了該重排反應,這是客烯醇的前體,後者是香根草精油的主要成分[37]。
合成Hirsutene和Isocomene[編輯]
Hudlicky是推動乙烯基環丙烷重排作為天然產物合成方法的關鍵人物之一,他從結構相似的前體出發,同時利用該反應合成了線型和角型的三奎烷[註 3],依次成功合成了毛鈎藤烯[38][註 4]和無舌黃菀烯[39][註 5]。

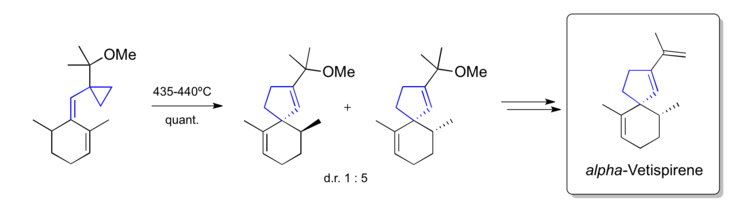
合成α-Vetispirene[編輯]
Paquette[40]在1982年使用乙烯基環丙烷重排反應構建了具有岩蘭烷結構的螺[4,5]癸三烯天然產物α-Vetispirene,這是一種天然倍半萜化合物,也是香根草油的成分之一。
合成Antheridiogen-An[編輯]
E. J. Corey與他的學生Andrew G. Myers在1985年發表了令人印象深刻的合成[41],他們在合成後期使用路易斯酸介導的乙烯基環丙烷重排合成了Antheridiogen-An。

合成生物素和氯吡格雷[編輯]
Njardarson等人[42]用銅催化的乙烯基噻丙環重排合成生物素的四氫噻吩核心和氯吡格雷的噻吩核心。

合成Salviasperanol[編輯]
Majetich等人[43]利用三氟乙酸或溴化鎂等路易斯酸介導的重排反應合成了Salviasperanol。

備註[編輯]
參見[編輯]
參考文獻[編輯]
- ^ Mil'vitskaya, E M; Tarakanova, A V; Plate, Alfred F. Thermal Rearrangements of Vinylcyclopropanes. Russ Chem. Rev. 1976, 45: 469–478. doi:10.1070/RC1976v045n05ABEH002675.
- ^ Goldschmidt, Z.; Crammer, B. Vinylcyclopropane rearrangements. Chem. Soc. Rev. 1988, 17: 229–267. doi:10.1039/CS9881700229.
- ^ Hudlicky, Tomas; Reed, Josephine W. From Discovery to Application: 50 Years of the Vinylcyclopropane-Cyclopentene Rearrangement and Its Impact on the Synthesis of Natural Products. Angewandte Chemie International Edition. 2010, 49 (29): 4864–76. PMID 20586104. doi:10.1002/anie.200906001.
- ^ Woodworth, Robert C.; Skell, Philip S. Reactions of bivalent carbon species. Addition of dihalocarbenes to 1,3-butadiene. J. Am. Chem. Soc. 1957, 79 (10): 2542. doi:10.1021/ja01567a048.
- ^ Doering, W. von E.; Hoffman, A. Kentaro. The Addition of Dichlorocarbene to Olefins. J. Am. Chem. Soc. 1954, 76 (23): 6162. doi:10.1021/ja01652a087.
- ^ Neureiter, Norman. Pyrolysis of 1,l-Dichloro-2-vinylcyclopropane. Synthesis of 2-Chlorocyclopentadiene. J. Org. Chem. 1959, 24 (12): 2044. doi:10.1021/jo01094a621.
- ^ Vogel, Emanuel. Kleine Kohlenstoff-Ringe. Angewandte Chemie. 1960, 72: 4–26. doi:10.1002/ange.19600720103.
- ^ Overberger, C. G.; Borchert, A. E. Novel thermal rearrangements accompanying acetate pyrolysis in small ring systems. J. Am. Chem. Soc. 1960, 82 (4): 1007. doi:10.1021/ja01489a069.
- ^ Overberger, C. G.; Borchert, A. E. Ionic Polymerization. XVI. Reactions of 1-Cyclopropylethanol-Vinylcyclopropane. J. Am. Chem. Soc. 1960, 82 (18): 4896. doi:10.1021/ja01503a036.
- ^ Doering, W. von E.; Lambert, J. B. Thermal Reorganization of a- and b-Thujene: A degenerate rearrangement of the vinylcyclopropane type. Tetrahedron. 1963, 19 (12): 1989. doi:10.1016/0040-4020(63)85013-9.
- ^ Atkinson, R. S.; Rees, C. W. A vinylaziridine to pyrroline rearrangement. Chemical Communications (London). 1967, (23): 1232a. doi:10.1039/C1967001232a.
- ^ Lwowski, Walter; Rice, Susan N.; Lwowski, Walter. Singlet and Triplet Nitrenes. 111. The Addition of Carbethoxynitrene to 1,3-Dienes. J. Org. Chem. 1968, 33 (22): 481. doi:10.1021/jo01266a001.
- ^ Paladini, J; Chuche, X. X. Rearrangement thermique d'epoxydes vinyliques. Tetrahedron Letters. 1971, 12 (46): 4383. doi:10.1016/S0040-4039(01)97447-7.
- ^ Demjanow, N. J.; Dojarenko, Marie. Über Vinylcyclopropan, einige Derivate des Methyl-cyclopropyl-carbinols und die Isomerisation des Cyclopropan-Ringes. Ber. Dtsch. Chem. Ges. B. 1922, 55 (8): 2718 [2021-12-07]. doi:10.1002/cber.19220550846. (原始內容存檔於2021-12-07).
- ^ Cloke, J. B.; Borchert, A. E. The formation of pyrrolines from gamma-chloropropyl and cyclopropyl ketimines. J. Am. Chem. Soc. 1929, 51 (18): 1174. doi:10.1021/ja01379a028.
- ^ Wilson, C. L.; Borchert, A. E. Reactions of Furan Compounds. VII. Thermal Interconversionof 2,3-Dihydrofuran and Cyclopropane Aldehyde. J. Am. Chem. Soc. 1947, 69 (18): 3002. doi:10.1021/ja01204a020.
- ^ 17.0 17.1 Baldwin, John E. Thermal Rearrangements of Vinylcyclopropanes to Cyclopentenes. Chemical Reviews. 2003, 103 (4): 1197–212. PMID 12683781. doi:10.1021/cr010020z.
- ^ Flowers, M. C.; Rabinovitch, B. S. The Thermal Unimolecular Isomerisation of Vinylcyclo- propane to Cyclopentene. J. Chem. Soc. 1960, 82 (23): 3547. doi:10.1021/ja01508a008.
- ^ Schlag, E. W.; Rabinovitch, B. S. Kinetics of the Thermal Unimolecular Isomerization Reactions of Cyclopropane-d2. J. Am. Chem. Soc. 1960, 82 (23): 5996. doi:10.1021/ja01508a008.
- ^ Egger, K. W.; Golden, David M.; Benson, Sidney W. Iodine-Catalyzed Isomerization of Olefins. 11. The Resonance Energy of the Allyl Radical and the Kinetics of the Positional Isomerization of 1-Butene. J. Am. Chem. Soc. 1964, 86 (24): 5420. doi:10.1021/ja01078a011.
- ^ Woodward, R. B.; Hoffmann, R. The Conservation of Orbital Symmetry. Angew. Chem. Int. Ed. 1969, 8 (11): 781. doi:10.1002/anie.196907811.
- ^ Gajewski, Joseph J.; Squicciarini, Michael P. Evidence for concert in the vinylcyclopropane rearrangement. A reinvestigation of the pyrolysis of trans-1-methyl-2-(1-tert-butylethenyl)cyclopropane. Journal of the American Chemical Society. 1989, 111 (17): 6717. doi:10.1021/ja00199a035.
- ^ Gajewski, Joseph J.; Olson, Leif P. Evidence for a dominant suprafacial-inversion pathway in the thermal unimolecular vinylcyclopropane to cyclopentene 1,3-sigmatropic shift. Journal of the American Chemical Society. 1991, 113 (19): 7432. doi:10.1021/ja00019a056.
- ^ Gajewski, Joseph J.; Olson, Leif P.; Willcott, M. Robert. Evidence for Concert in the Thermal Unimolecular Vinylcyclopropane to Cyclopentene Sigmatropic 1,3-Shift. Journal of the American Chemical Society. 1996, 118 (2): 299. doi:10.1021/ja951578p.
- ^ Corey, E. J.; Walinsky, S. W. Reaction of 1,3-dithienium fluoroborate with 1,3-dienes. Synthesis of .DELTA.3-cyclopenten-1-ones. Journal of the American Chemical Society. 1972, 94 (25): 8932. doi:10.1021/ja00780a063.
- ^ Simpson, John M.; Richey, Herman G. The effects of methoxyl and phenyl substituents on the thermal rearrangements of vinylcyclopropane. Tetrahedron Letters. 1973, 14 (27): 2545. doi:10.1016/S0040-4039(01)96201-X.
- ^ Trost, Barry M.; Bogdanowicz, Mitchell J. New synthetic reactions. IX. Facile synthesis of oxaspiropentanes, versatile synthetic intermediates. Journal of the American Chemical Society. 1973, 95 (16): 5311. doi:10.1021/ja00797a036.
- ^ Trost, Barry M.; Keeley, Donald E. New synthetic methods. A stereocontrolled approach to cyclopentane annelation. Journal of the American Chemical Society. 1976, 98: 248–250. doi:10.1021/ja00417a048.
- ^ Paquette, Leo A.; Meehan, George V.; Henzel, Richard P.; Eizember, Richard F. Photochemistry of conjugated cis-bicyclo[5.1.0]octenones, cis- and trans-bicyclo[5.2.0]non-2-en-4-ones, and their methylene analogs. The Journal of Organic Chemistry. 1973, 38 (19): 3250. doi:10.1021/jo00959a004.
- ^ Paquette, Leo A.; Henzel, Richard P.; Eizember, Richard F. Thermochemical behavior of conjugated cis-bicyclo[5.1.0]octenones, cis- and trans-bicyclo[5.2.0]non-2-en-4-ones, and their methylene analogs. The Journal of Organic Chemistry. 1973, 38 (19): 3257. doi:10.1021/jo00959a005.
- ^ Hudlicky, Tomas; Koszyk, Francis F.; Kutchan, Toni M.; Sheth, Jagdish P. Cyclopentene annulation via intramolecular addition of diazoketones to 1,3-dienes. Applications to the synthesis of cyclopentanoid terpenes. The Journal of Organic Chemistry. 1980, 45 (25): 5020. doi:10.1021/jo01313a003.
- ^ Brown, Vanessa; Brown, John M.; Conneely, John A.; Golding, Bernard T.; Williamson, David H. Synthesis and thermolysis of rhodium and iridium complexes of endo-6-vinylbicyclo[3.1.0]hex-2-ene. A metal-promoted vinylcyclopropane to cyclopentene rearrangement. Journal of the Chemical Society, Perkin Transactions 2. 1975, (1): 4. doi:10.1039/P29750000004.
- ^ Danheiser, Rick L.; Martinez-Davila, Carlos; Morin, John M. Synthesis of 3-cyclopentenols by alkoxy-accelerated vinylcyclopropane rearrangement. The Journal of Organic Chemistry. 1980, 45 (7): 1340. doi:10.1021/jo01295a045.
- ^ Larsen, Scott D. A stereoselective synthesis of functionalized cyclopentenes via base-induced ring contraction of thiocarbonyl Diels-Alder adducts. Journal of the American Chemical Society. 1988, 110 (17): 5932–5934. doi:10.1021/ja00225a072.
- ^ Hudlicky, Tomas; Heard, Nina E.; Fleming, Alison. 4-Siloxy-.alpha.-bromocrotonate: A new reagent for [2+3] annulation leading to oxygenated cyclopentenes at low temperatures. The Journal of Organic Chemistry. 1990, 55 (9): 2570. doi:10.1021/jo00296a004.
- ^ Trost, B. M.; Nishimura, Yoshio; Yamamoto, Kagetoshi. A Total Synthesis of Aphidicolin. J. Am. Chem. Soc. 1979, 101 (5): 1328. doi:10.1021/ja00499a071.
- ^ Piers, E. Five-membered Ring Annelation via Thermal Rearrangement of a-Cyclopropyl-ab-unsaturated Ketones: a New Total Synthesis of (&)-Zizaene. J. Chem. Soc. Chem. Commun. 1979, (24): 1138. doi:10.1039/C39790001138.
- ^ Hudlicky, T.; Kutchan, Toni M.; Wilson, Stephen R.; Mao, David T. Total Synthesis of (rac)-Hirsutene. J. Am. Chem. Soc. 1980, 102 (20): 6351. doi:10.1021/ja00540a036.
- ^ Hudlicky, T.; Kavka, Misha; Higgs, Leslie A.; Hudlickyl, Tomas. Stereocontrolled Total Synthesis of Isocomene Sesquiterpenes. Tetrahedron Lett. 1984, 25 (23): 2447. doi:10.1016/S0040-4039(01)81201-6.
- ^ Paquette, L. A. A Short Synthesis of (rac)-alpha-Vetispirene. Tetrahedron Lett. 1982, 23: 3227. doi:10.1016/s0040-4039(00)87576-0.
- ^ Corey, E. J.; Myers, Andrew G. Total Synthesis of (rac)-Antheridium-Inducing Factor (AAn,2) of the Fern Anemia pbylfitidis. Clarification of Stereochemistry. J. Am. Chem. Soc. 1985, 107 (19): 5574. doi:10.1021/ja00305a067.
- ^ Njardarson, J. T.; Araki, H; Batory, LA; McInnis, CE; Njardarson, JT. Highly Selective Copper-Catalyzed Ring Expansion of Vinyl Thiiranes: Application to Synthesis of Biotin and the Heterocyclic Core of Plavix. J. Am. Chem. Soc. 2007, 129 (10): 2768–9. PMID 17302422. doi:10.1021/ja069059h.
- ^ Majetich, G.; Zou, G; Grove, J. Total Synthesis of (−)-Salviasperanol. Org. Lett. 2008, 10 (1): 85–7. PMID 18052176. doi:10.1021/ol701743c.
