霍爾-埃魯法
霍爾—埃魯法(英語:Hall–Héroult process,又稱霍爾法、郝耳法)是電解氧化鋁和冰晶石(主要成分是氟鋁酸鈉,Na3AlF6)的熔融混合物製取鋁的化工過程。於1886年由美國化學家查爾斯·馬丁·霍爾和法國化學家保羅·埃魯各自獨立發明。霍爾—埃魯法和其後的拜耳法的聯用大大提高了鋁的產量,擴大了鋁的應用範圍,至今仍然是主要的工業制鋁方法。[1]
背景
[編輯]
對金屬鋁的需要
[編輯]雖然鋁是地殼中含量最高的金屬元素,但其化學性質較為活潑,多以化合物形式如鋁土礦等存在,而少以單質形式存在。1825年,丹麥化學家漢斯·克里斯蒂安·奧爾斯泰德發明了用鉀還原鋁土礦的方法,獲得了少量的金屬鋁[2]。之後很長時間,煉鋁的方法都是將鋁土礦和鈉或者鉀在真空中共熱,由於工藝複雜,且當時鈉和鉀都只能通過電解獲得,本身就價格不低,這就導致了當時一小塊鋁的價格都非常高,甚至高過金和鉑。1855年世界博覽會就曾將一塊鋁和法國的皇冠珠寶一起展出,而拿破崙三世的鋁餐具也只有在最尊貴的客人出席時才使用[3]。到1884年建造華盛頓紀念碑頂部的鋁製金字塔時,鋁的價格仍然和銀相當[4]
霍爾和埃魯的發現
[編輯]由於電解鋁鹽溶液時,氫離子比鋁離子先獲得電子,所以無法像銅和鋅那樣,通過電解鋁鹽溶液製取鋁的單質。亨利·埃蒂恩·桑蒂—克萊爾·德維爾就採用電解熔融氯化鋁鈉復鹽(NaCl·AlCl3)的方法製得了鋁[5]。1886年,美國化學家查爾斯·馬丁·霍爾受到德維爾實驗的啟發,試驗了螢石、氟化鎂等助熔劑之後,選定冰晶石作為氧化鋁的助熔劑[6]。幾乎同時,法國化學家保羅·艾魯也從德維爾的發現着手,希望電解熔融冰晶石制鋁,多次失敗後意識到要加入鋁土礦,從而發明了同樣的方法。1888年,霍爾在匹茲堡開設了匹茲堡還原公司。後來演變變成美國鋁業公司(Alcoa)[7]。
過程
[編輯]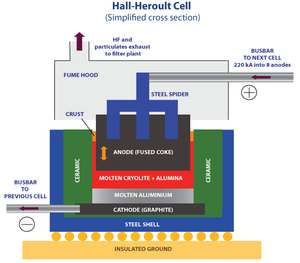
理論
[編輯]霍爾—埃魯法的基本反應是電解熔融的氧化鋁製得單質鋁:
- 2Al2O3(熔融)→4Al+3O2
由於氧化鋁的熔點超過2000°C,電解過程所需的熱力和電力成本過高,無法投入實際應用。霍爾—埃魯法將氧化鋁溶於冰晶石(Na3AlF6)中,一方面可以降低熔點,另一方面也可以改變電解進程,但其具體作用機理還不完全清楚[8]。純冰晶石的熔點大約是1012°C。少量氧化鋁溶入其中後,混合物的熔點降到大約1000°C,有時候會加入氟化鋁以進一步降低熔點,使得反應可以在950‒980°C範圍中進行[1]。
冰晶石、氧化鋁和氟化鋁的混合溶液加上直流電壓後,帶正電的鋁離子會聚集在陰極附近,鋁離子獲得電子生成單質鋁,而氧離子則在石墨或焦炭製成的陽極附近失去電子,生成氧原子。在高溫下,氧原子和碳生成一氧化碳和二氧化碳氣體逸出電解池,製取一公斤鋁一般需要消耗掉0.4—0.5公斤的碳[9]。按照理論計算,生成一公斤鋁所耗能量為8.7千瓦時。陽極上生成二氧化碳的反應是放熱的,放出的熱量可以補充一部分用於熔融的能量,而電阻的存在又需要多餘的能量,最後現代工業規模的鋁電解池一般需11.5—13.5千瓦時的電能生產1公斤鋁[1]。霍爾—埃魯法所用的電解池通常使用的電流都達數百安培[9]。
技術細節
[編輯]電解池中的溫度通過電阻元件控制,石墨陽極的氧化增加了電流的效率。雖然室溫下固態的冰晶石比固態鋁密度要大,而在1000°C左右,鋁的密度(大約2.3 g/cm3)大於熔融的冰晶石(大約2.1 g/cm3)。於是在高溫下,鋁會沉積在電解池的底部,通過虹吸原理從電解池中移出。移除鋁的同時,加入氧化鋁以維持生產[8]。
霍爾—艾魯法所用的陽極一般主要成分都是石油工業獲得的焦炭和石油焦,其主要的製取方法是索德伯格法(自培法)和預培法。索德伯格法需通過不斷在陽極添加瀝青來保持過程的循環,生產過程中一部分熱用於讓瀝青碳化為焦炭。而預培技術(Prebake)則是事先將陽極材料碳化,製成一定形狀的預培陽極這樣可以避免瀝青碳化中產生了各種具有污染性的副產物[10]電解池的陽極所產生的二氧化碳通常直接排放到空氣中,過程還會產生氟化氫和四氟化碳,氟化氫一般以尾氣回收形式與氧化鋁產生氟化鋁,繼續作為煉鋁原料使用[11]。固體顆粒物則一般通過靜電濾網除去。攪拌混合熔體可以提高產率,但同時也會增加產品中的冰晶石雜質的含量。合理設計的電解池可以通過磁流體動力學進行攪拌。
演變與影響
[編輯]1887年,奧地利工程師卡爾·約瑟夫·拜耳發明了拜耳法,可以將鋁土礦轉化成純氧化鋁,相對於鋁土礦,使用純氧化鋁為原料可以提高霍爾—埃魯法的效率。拜耳法和霍爾—埃魯法聯用,加之電力成本的降低,使鋁得以大量生產,最終成為僅次於鋼的常用金屬材料。這一發明也讓胡戈·容克斯可以利用鋁和鋁合金設計出全金屬飛機[12]。1997年,美國鋁業公司對霍爾—艾魯過程的商業化被列入美國化學會國家歷史化學地標[13]。
參考文獻
[編輯]- ^ 1.0 1.1 1.2 Christoph Schmitz. Handbook of Aluminium Recycling. Vulkan-Verlag GmbH. 2006: 18-24.
- ^ Robert E. Krebs. The History and Use of Our Earth's Chemical Elements: A Reference Guide. Greenwood Publishing Group. 2006: 179-180.
- ^ Nigel Saunders. Aluminum and the Elements of Group 13. Heinemann-Raintree Library. 2004.
- ^ George J. Binczewski. The Point of a Monument: A History of the Aluminum Cap of the Washington Monument. JOM. 1995, 47 (11): 20–25 [2014-02-05]. (原始內容存檔於2016-01-24).
- ^ 中国大百科全书. 中國大百科全書出版社. 2010: 183–184.
- ^ 美國專利400664(於1889年04月02日註冊)Charles Martin Hall——Process of Reducing Aluminium from its Fluoride Salts by Electrolysis。
- ^ history of alcoa. [2014-02-08]. (原始內容存檔於2016-10-19).
- ^ 8.0 8.1 H.Panda. The Complete Book on Electroplating & Allied Chemicals. ASIA PACIFIC BUSINESS PRESS Inc. 2013: 170.
- ^ 9.0 9.1 DUBAL 2008 installed cell amperage for DX Technology. [2014-02-09]. (原始內容存檔於2013-09-27).
- ^ James A. Kent. Handbook of Industrial Chemistry and Biotechnology: Volume 1 and 2, Volume 1. Springer,. 2013: 1527-1528.
- ^ John A. S. Green. Aluminum Recycling and Processing for Energy Conservation and Sustainability. ASM International. 2007: 187-189.
- ^ Lund Boat Company Founder Dies at 91. [2014-02-08]. (原始內容存檔於2014-02-22).
- ^ A National Historic Chemical Landmark: Production Of Aluminum Metal By Electrochemistry - Charles Martin Hall Solves The Aluminum Challenge. [2014-02-08]. (原始內容存檔於2014-02-24).
