2-降冰片基碳正离子
| 2-降冰片基碳正离子 | |
|---|---|

| |
| 识别 | |
| CAS号 | 24321-81-1 |
| 性质 | |
| 化学式 | C 7H 11+ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
2-降冰片基碳正离子(英语:2-Norbornyl cation,IUPAC命名法为2-双环[2.2.1]庚基阳离子)是降冰片烷的三种碳正离子中间体之一,化学式为C
7H
11+。
2-降冰片基离子的3c-2e非经典碳正离子假想结构最早由Saul Winstein在1949年提出[1],其后围绕非经典碳正离子结构之争持续了约半个世纪,直至2013年F. Scholz等人通过低温XRD确定了降冰片基正离子的非经典离子晶体结构[2],才最后为其“盖棺论定”。时至今日,学界普遍都认可2-降冰片基碳正离子的非经典结构,但也意识到,某一离子的经典结构与非经典结构间转换的能垒可能并不大,如一些烷基取代的2-降冰片基衍生物同样会采取经典结构[3]。
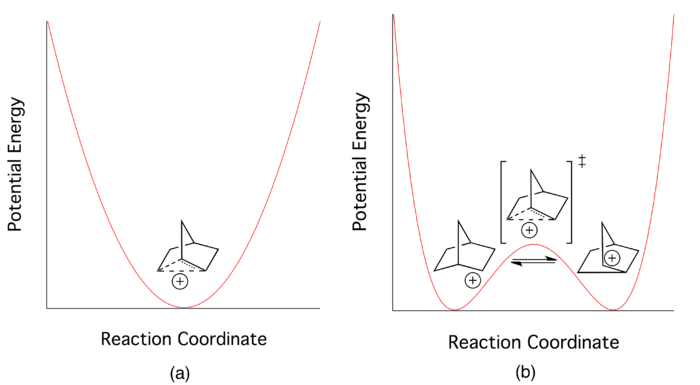
理论
[编辑]在20世纪中叶,关于2-降冰片基阳离子的键合形式,学界进行了多次激烈而著名的争论,一方提出非经典碳正离子理论,尽管该理论在当时缺乏直接的实验依据支撑,但有相当数量的有机化学家非常轻易地接纳了这一理论;一方则批评其理论的“软性”,并认为在进一步的事实证据出现前,2-降冰片基碳正离子应该通过一对快速平衡的经典结构来解释,二者在当时各有拥趸。不过即便在理论上有争辩,大多数化学家都认同2-降冰片基阳离子中存在电子离域。研究人员们试图通过新方法找到一个低能量的过渡态(即多维势能面上的鞍点)或其本身的能量最低点,支持经典理论的一方认为,双势阱模型是“最适配”的解释,其中可能存在一个能量略高的过渡态;支持非经典理论的一方认为,反应中的势能最低点处即是非经典结构的阳离子[4]。因此,两方争论的核心也就演变成了,非经典碳正离子究竟是一个反应过渡态,还是一个可分离的中间体。
非经典结构之共振论
[编辑]2-降冰片基碳正离子被认为是最具代表性的非经典碳正离子,所谓非经典碳正离子是指一类有机阳离子,其中包含一个三中心两电子键,同时有σ键和π键参与[5]。一些简单的有机阳离子,如质子化的乙炔(乙炔基阳离子,C
2H+
3)、质子化的乙烯(乙烯基阳离子,C
2H+
5)和质子化的乙烷(乙基阳离子,C
2H+
7),已有红外光谱学研究描述了其非经典阳离子的结构[6]。

非经典结构理论的支持者们通常愿意用共振式或带虚线键的超价结构来表示2-降冰片基碳正离子(图2)。该超价结构可以被拆分为:C1-C6间的部分σ键、C2-C6间的部分σ键和C1-C2间的部分π键,对应了三种共振结构[7]。

关于π键结构的共振式对离域电子结构的实际贡献曾有争议[9],但通过1H和13C NMR光谱证实了C6上存在少量正电荷[10];也有报道称可以通过β-(Δ3-环戊烯基)-乙烷的酯衍生物来构建2-降冰片基阳离子结构,证明了含π键的共振结构是重要的[11]。
以分子轨道理论来理解2-降冰片基阳离子(图3),可以认为该超价键由C1、C2上的p轨道和C6上的一个sp3组成[8][12]。对2-降冰片基阳离子的扩展休克尔方法分子轨道计算结果表明,C6上的轨道可能是sp2杂化的,但这只会影响其上偕氢的几何形状[13]。
经典结构之快速平衡论
[编辑]
经典结构的支持者们认为,通过两个不对称对映体的快速平衡,就可以不打破经典结构而解释降冰片基阳离子的稳定性,Wagner-Meerwein重排反应被援引用以支持此观点。该理论的解释虽然符合溶剂解反应速率的结果,不过分离这两个对映体的努力全部付诸东流。有报道指出是由于2-降冰片基衍生物的溶剂解反应中极快的正向与逆向反应速率,也侧面表明了两个对映体间转化的能垒非常低[7]。
其他理论
[编辑]1951年有人提出,降三环烯基阳离子[注 1]是更能代表2-降冰片基阳离子的非经典离子结构,这是一个C3对称的降三环烯[注 2]离子。这种结构最早被用来部分解释14C同位素标记实验的结果[14]。分子轨道表示该结构包含C1、C2和C6的sp2杂化轨道与共用氢原子上1s轨道间的同相相互作用[15]。
历史
[编辑]引入概念
[编辑]非经典碳正离子与传统阳离子的电子结构不同,经典的化学键被理解为两个原子共享一对电子,但在稳定的非经典碳正离子中则是三个(或更多)原子共享一对电子[5]。在1939年,Thomas Nevell等人试图阐明莰烯盐酸盐转化为氯代异冰片的机理。该论文中拟议的一个机理中,描述了一个中间体的阳离子电荷没有依附于某个原子,而是分配到了整体结构上[16]。该研究被认为是有机化学历史上首次引出非经典碳正离子的概念[17]。不过,非经典离子这一术语,则是直到12年后才被使用,在一篇研究烯丙基卡宾互变异构中间体的研究中被用以表示一个三角锥形的丁基阳离子中的离域键[18]。在早期研究阶段,有研究者猜测此类型的阳离子键合方式与硼烷相似[19]。
早期发展
[编辑]1949年,Saul Winstein发现外型-2-对溴苯磺酸降冰片酯和内型-2-对甲苯磺酸降冰片酯在乙酰解[注 3]反应中得到了相同的外消旋混合产物——外型-2-降冰片基乙酸盐(图6)。鉴于Bs与Ts的离去速率接近,Winstein提出内/外型-2-降冰片基均通过相同的碳正离子中间体发生溶剂解反应,并且这个中间体可能是对称、离域的2-降冰片基碳正离子。[1]之后的气相色谱研究表明,该反应产物的内型差向异构体含量低于0.02 %,证明了该反应的高度立体选择性 [20]。


Winstein认为在离去基团离去后,外型底物更易于形成对称的中间体阳离子,因此亲核试剂能从两端同时进攻,得到外消旋的产物[1]。实验中还发现外型底物的溶剂解速率比内型底物的要快350倍,被解释为外型的C1- C6σ键的邻助效应,帮助形成了具对称面的中间体[1]。该理论被后世认为是对非经典碳正离子的确切阐释,也使得许多有机化学家相信2-降冰片基碳正离子的稳定性正是基于其对称且非经典的桥环结构(并借此推广出了许多更复杂的非经典离子);也有一些作者选择通过其他理论来解释这一特殊稳定性[3]。
异议渐起
[编辑]尽管非经典碳正离子在许多化学家眼中是完美的理论,赫伯特·布朗却认为引入一种缺乏依据的新型键合方式是多此一举。布朗批评非经典碳正离子理论的支持者们忽视过去对反应性的解释,并认为上述的“反常”现象都可以通过简单的立体效应来解释[7]。他认为使用一对快速平衡的对映体,便可以解释此碳正离子的高反应性、内外型溶剂解速率差异和产物立体选择性等诸多现象,因而没有必要使用一个新的理论[21]。布朗认为这一做法对整个化学界发展而言是适得其反,并且也的确有许多相关论文因不切实际而被退回[4]。这一观点自1962年提出后,引发了许多争议,布朗也开始寻找实验证据支撑自己的观点[22]。
布朗还尝试证明2-降冰片基碳正离子离域的不稳定性,并尝试论证将离域结构看作是两个不对称阳离子间的过渡态[4][23]。尽管他并不反对离域过渡态的可能性,但即使是在其研究事业的晚期,布朗仍坚持拒绝认可2-降冰片基阳离子的镜面对称性 [24]。
总体影响
[编辑]2-降冰片基碳正离子所引述的3c-2e键让化学家们着眼于探索全新的化学键领域,他们急于将新的超价理论套进旧的系统和新的发现中,而在这一过程中也出现了许多不够严谨的研究[9]。围绕非经典离子的研究中,触及了一个最根本的基础概念,即已成σ键的电子所表现出的反应性。虽然人们早就知道π轨道能作为电子供体参与反应,但却缺乏理论和实验依据来证明σ轨道具有相同的功能。2-降冰片基阳离子的非经典结构可以被看作是一个σ键的电子对被提供给了碳正离子上的空p轨道,许多研究实质上是寄希望于此来开拓有机化学的新理论[25][26]。
布朗与非经典离子理论支持者的激烈争论也极大地推动了该领域发展,为了驳斥对方的观点,双方都竭尽所能地寻找新的表征技术和对现有数据进行建模[27]。随着超酸的应用和低温核磁共振分析方法的进步,使人们可以掌握非经典离子结构的更多数据[3]。2-降冰片基阳离子的过渡态和离域假说,促使人们对过渡态进行更频繁的研究,极大地提高了学界对其电子结构的理解[27]。
合成
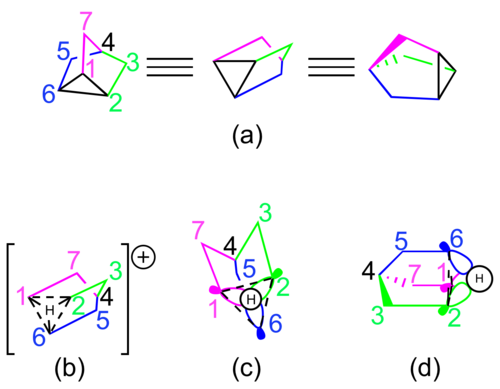
[编辑]2-降冰片基碳正离子可以通过三种途径合成:σ-途径、π-途径和β-Δ3-途径。

σ途径
[编辑]此途径的起始材料是外型的2-降冰片衍生物,在强酸性条件下,邻近σ键的电子被提供给离去基团和C2上的σ*轨道(图8a)[28]。
如果底物的离去基团处于内型位置,那么这一过程机理相比外型要慢得多,可能有缺乏σ轨道邻助效应的原因,此构型的离去基团可以发生SN2反应,如果反应体系中还存在高浓度的亲电体,那么会因竞争反应而产生构型反转的产物[1][29]。
π途径
[编辑]此途径的起始材料是β-(Δ3-环戊烯基)乙烷衍生物,离去基团位于乙基末端位置,π轨道中的电子填充到末端碳原子和离去基团间的σ*轨道(图8c)[28][29]。例如,对硝基苯磺酸-β-(Δ3-环戊烯基)乙酯的乙酰解主要产物是外型-2-降冰片酯,只有少量β-(Δ3-环戊烯基)乙酸乙酯产物,原因是非经典离子结构比取代的环戊烯结构更加稳定[11]。
此路线要求底物中的双键(环戊烯基)独立于其他的π键系统,如果双键同时参与了芳香环离域,如对硝基苯磺酸-2-茚满乙基酯,反应速率就会显著地降低[30]。
几何结构
[编辑]光谱研究
[编辑]鉴于2-降冰片基阳离子的三种假想结构都表现出至少一种不同的对称性,Olah等人尝试从分子对称性切入,来检验2-降冰片基碳正离子的非经典结构,如核磁共振光谱、拉曼光谱等。在氟锑酸盐环境下,早期核磁共振光谱只有一个宽峰,表明其上氢原子是化学等效的,证明了在室温下的稳定2-降冰片基阳离子中氢迁移速度较快。随着更精细和低温的核磁共振技术发展,才逐渐从中解出更多的结构信息,在低温下的氢核磁共振光谱基本与非经典离子结构的预期相符[31][32]。
低温核磁共振光谱发现,2-降冰片基阳离子的互变异构信号逐渐“被冻结” [33],但即使在-156 ℃下仍能观察到2-降冰片基阳离子的Wagner-Meerwein重排反应(1,2-碳迁移)的分裂信号,其速度都快于NMR实验的最小尺度[34][35]。不过,当时的低温NMR研究没有证明或证伪这两个理论[10]。80年代的固体NMR分析发现,5 K(-268 ℃)下2-降冰片基碳正离子固体的13C谱图中,没有发现C1、C2峰分裂的信号,这表明要么2-降冰片基阳离子中存在活化能极低的平衡反应,要么就是非经典碳正离子理论的胜利[36]。
2-降冰片基碳正离子的拉曼光谱展现出更对称的结构,由于假想的平衡重排反应速率低于拉曼光谱的尺度,如果经典结构是正确的,应该会出现不太对称的拉曼光谱[9]。
一些13C核磁共振研究者倾向于用降三环烯基阳离子结构来解释[37]。在强酸性环境中的拉曼光谱在3110 cm-1处的吸收带被认为是缺电子的环丙烷环,一部分研究者将其作为降三环烯结构的证据[38]。其他化学家推测,2-降冰片基碳正离子的特性可能非常依赖溶剂环境,在强酸性、低亲核性的环境下降三环烯基阳离子的几何形成可能是最稳定的,而在其他环境中则未必如此[9]。
计算研究
[编辑]许多计算研究被用来验证可能的几何结构,采用MINDO/3半经验方法,没有得出哪种2-降冰片基碳正离子的几何结构在能量上是有利的。然而,2-甲基-2-降冰片基碳正离子的经典结构被发现是唯一的可能最低值[39]。而通过拓展休克尔方法进行分子轨道计算结果有利于具反射对称性的非经典离子结构[13][40]。
热力学
[编辑]有研究基于2-降冰片基碳正离子的离域性,比较了其烷基衍生物的热力学稳定性。通过比较2/3-甲基-2-降冰片基碳正离子与异戊烷仲/叔碳正离子间的重排反应,发现降冰片系统的焓变要低6 kcal/mol。由于这二种可逆重排反应的主要差别是电子排布时可能发生的离域,似乎可以把降冰片系统的特殊性归因于其非经典结构[41]。不过,有研究指出未能在溶剂解反应中观察到此类稳定化能[4]。
其他对于2-降冰片基碳正离子的稳定性研究表明,C1、C2的烷基取代会使该离子变为经典结构[42],叔碳比仲碳要稳定的多,因此不需要采取离域便可以转变为最低势能的结构[43]。
动力学
[编辑]Winstein和Trifan首先提出动力学证据来提出非经典碳正离子,他们推断在反应中存在非经典结构的离子以解释内外型反应速率差异[1]。其后有其他研究调查了可能同样提供σ邻助效应的非降冰片系统的化合物,发现有相似的反应速率变快的趋势,一些报告也将此作为非经典离子的证据[44]。布朗为代表的的其他研究者则不同意这一点,他们发现在结构上与降冰片体系类似的环戊烷衍生物也具有提升反应速率的特点,并由此作为经典结构的论据[45][46]。
同位素标记实验
[编辑]
研究人员们在放射性同位素标记实验中找到了非经典结构离域键的证据(图9),非经典结构的支持者预期在2-降冰片基离子的分解反应中含有50%的含14C的CO2,而经典结构理论的支持者则认为,由于过渡态短寿的特点,分解的CO2中会含有更多的放射性原子。而观察到的CO2中约有40%的含放射性,更偏向于非经典结构理论[15]。
将氢核磁共振与同位素标记相结合,进一步支持了非经典离子理论。2-降冰片基碳正离子上不对称位置的氘标记将使得研究者们能通过分析谱图上分裂的峰,将碳原子分为2或3组等效位置。如果该系统中存在快速平衡,那么相关位置的峰值会出现显著的分裂(10-100ppm);如果该系统是“静态”的,那么该分裂则很微小[47][48]。2-降冰片基阳离子在-150 ℃左右的13C NMR谱图表明,C1、C2处的分裂小于10ppm,印证了非经典离子的理论[49]。
X射线晶体学
[编辑]2-降冰片基碳正离子晶体结构的测定是非经典结构的直接证据,不过却没有制得标准状况下的晶体。近期,Scholz等人通过对2-降冰片基碳正离子的七溴合二铝酸盐在低温下进行XRD,确定了[C
7H
11]+[Al
2Br
7]−·CH
2Br
2的晶体结构[2]。
为了排除单晶相变时原子取向无序的影响,该报道指出在86 K时单晶结构会经历有序-无序的转化过程,通过仔细的退火操作,在40 K时的有序相中收集到了三个晶体学独立的2-降冰片基非经典离子结构。研究人员还发现,C6和C1、C2间的键长略长于典型的烷烃σ键[2]。
脚注
[编辑]参见
[编辑]参考文献
[编辑]- ^ 1.0 1.1 1.2 1.3 1.4 1.5 Winstein, S.; Trifan, D. S. The Structure of the Bicyclo[2,2,1]2-Heptyl (Norbornyl) Carbonium Ion. Journal of the American Chemical Society. 1949, 71 (8): 2953. doi:10.1021/ja01176a536.
- ^ 2.0 2.1 2.2 Scholz, F.; Himmel, D.; Heinemann, F. W.; Schleyer, P. V. R.; Meyer, K.; Krossing, I. Crystal Structure Determination of the Nonclassical 2-Norbornyl Cation. Science. 2013, 341 (6141): 62–64. Bibcode:2013Sci...341...62S. PMID 23828938. S2CID 206549219. doi:10.1126/science.1238849.
- ^ 3.0 3.1 3.2 Walling, C. An innocent bystander looks at the 2-norbornyl cation. Accounts of Chemical Research. 1983, 16 (12): 448–454. doi:10.1021/ar00096a004.
- ^ 4.0 4.1 4.2 4.3 Brown, H. C. The energy of the transition states and the intermediate cation in the ionization of 2-norbornyl derivatives. Where is the nonclassical stabilization energy?. Accounts of Chemical Research. 1983, 16 (12): 432–440. doi:10.1021/ar00096a002.
- ^ 5.0 5.1 Sargent, G. D. Bridged, non-classical carbonium ions. Quarterly Reviews, Chemical Society. 1966, 20 (2): 301–1073. doi:10.1039/QR9662000301.
- ^
Yeh, L. I.; Price, J. M.; Lee, Y. T. Infrared spectroscopy of the pentacoordinated carbonium ion C
2H+
7. Journal of the American Chemical Society. 1989, 111 (15): 5597. doi:10.1021/ja00197a015. - ^ 7.0 7.1 7.2 Brown, H. C. Question of σ Bridging in the solvolysis of 2-norbornyl derivatives. Accounts of Chemical Research. 1973, 6 (11): 377–386. doi:10.1021/ar50071a003.
- ^ 8.0 8.1
Streitwieser, Andrew. Chapter 12: Carbonium Ions. Molecular Orbital Theory for Organic Chemists
 . New York: John Wiley and Sons Inc. 1961: 357–391.
. New York: John Wiley and Sons Inc. 1961: 357–391.
- ^ 9.0 9.1 9.2 9.3 Sargent, George Dann. Chapter 24: The 2-Norbornyl Cation. Olah, George; von Schleyer, Paul (编). Carbonium Ions. Volume III: Major Types (Continued). New York: Wiley-Interscience: 1099–1200. 1971.
- ^ 10.0 10.1 Olah, G. A.; Liang, G.; Mateescu, G. D.; Riemenschneider, J. L. Stable carbocations. CL. Fourier transform carbon-13 nuclear magnetic resonance and x-ray photoelectron spectroscopic study of the 2-norbornyl cation. Journal of the American Chemical Society. 1973, 95 (26): 8698. doi:10.1021/ja00807a032.
- ^ 11.0 11.1 Lawton, R. G. 1,5-Participation in the solvolysis of β-(Δ3-cyclopentenyl)ethyl p-nitrobenzenesulfonate. Journal of the American Chemical Society. 1961, 83 (10): 2399. doi:10.1021/ja01471a047.
- ^ Olah, G. A.; Mateescu, G. D.; Riemenschneider, J. L. Electron spectroscopy of organic ions. II. Carbon 1s electron binding energies of the norbornyl, 2-methylnorbornyl, and related cations. Differentiation between nonclassical carbonium and classical carbenium ions. Journal of the American Chemical Society. 1972, 94 (7): 2529. doi:10.1021/ja00762a066.
- ^ 13.0 13.1 Trahanovsky, W. S. Molecular Orbital Calculations of the Norbornyl Cation Using an Extended Hückel Theory. The Journal of Organic Chemistry. 1965, 30 (5): 1666–1668. doi:10.1021/jo01016a517.
- ^ J. D. Roberts and C. C. Lee. The nature of the intermediate in the solvolysis of norbornyl derivatives. J. Am. Chem. Soc. 1951, 73 (10): 5009–5010. doi:10.1021/ja01154a555.
- ^ 15.0 15.1 15.2 Roberts, J. D.; Lee, C. C.; Saunders, W. H. Rearrangements in Carbonium Ion-Type Reactions of C14-Labeled Norbornyl Derivatives. Journal of the American Chemical Society. 1954, 76 (18): 4501. doi:10.1021/ja01647a001.
- ^ Nevell, T. P.; De Salas, E.; Wilson, C. L. 259. Use of isotopes in chemical reactions. Part I. The mechanism of the Wagner–Meerwein rearrangement. Exchange of radioactive chlorine and of deuterium between camphene hydrochloride and hydrogen chloride. Journal of the Chemical Society (Resumed). 1939: 1188–1199. doi:10.1039/JR9390001188.
- ^ Brown, H. C.; Liu, K. T. Additions to bicyclic olefins. VII. Electrophilic additions of hydrogen chloride and deuterium chloride to norbornene, 2-methylenenorbornane, and related bicyclic olefins. Evidence for a carbonium ion process and the capture of unsymmetrical (classical) 2-norbornyl cations. Journal of the American Chemical Society. 1975, 97 (3): 600. doi:10.1021/ja00836a022.
- ^ Roberts, J. D.; Mazur, R. H. The Nature of the Intermediate in Carbonium Ion-Type Interconversion Reactions of Cyclobutyl, Cyclopropylcarbinyl and Allylcarbinyl Derivatives. Journal of the American Chemical Society. 1951, 73 (7): 3542. doi:10.1021/ja01151a550.
- ^ Brown, F.; Hughes, E. D.; Ingold, C. K.; Smith, J. F. Wagner Changes, Synartetic Acceleration and Synartetic Ions. Nature. 1951, 168 (4263): 65. Bibcode:1951Natur.168...65B. S2CID 4283069. doi:10.1038/168065a0.
- ^ Winstein, S.; Clippinger, E.; Howe, R.; Vogelfanger, E. The Nonclassical Norbornyl Cation. Journal of the American Chemical Society. 1965, 87 (2): 376. doi:10.1021/ja01080a040.
- ^ Brown, Herbert. Strained Transition States. Special Publication. No. 16: The Transition State. London: The Chemical Society: 140–178. 1962.
- ^ Brown, H. C.; Chloupek, F. J.; Rei, M. H. Synthesis and Rates of Ethanolysis of 2-Phenyl-exo-norbornyl Chloride. The Question of a Nonclassical 1- and 2-Phenylnorbornyl Cation. Journal of the American Chemical Society. 1964, 86 (6): 1246. doi:10.1021/ja01060a058.
- ^ Brown, H. C.; Morgan, K. J.; Chloupek, F. J. Structural Effects in Solvolytic Reactions. I. The Role of Equilibrating Cations in Carbonium Ion Chemistry. Nature of the Intermediates Involved in the Solvolysis of Symmetrically Substituted β-Phenylethyl Derivatives. Journal of the American Chemical Society. 1965, 87 (10): 2137. doi:10.1021/ja01088a011.
- ^ Brown, H. C. Correspondence – the 2-norbornyl cation revisited. Accounts of Chemical Research. 1986, 19 (2): 34. doi:10.1021/ar00122a001.
- ^ Olah, G. A. Stable carbocations, 189. The σ-bridged 2-norbornyl cation and its significance to chemistry. Accounts of Chemical Research. 1976, 9 (2): 41–52. doi:10.1021/ar50098a001.
- ^ Olah, G. A.; Prakash, G. K. S.; Saunders, M. Conclusion of the classical-nonclassical ion controversy based on the structural study of the 2-norbornyl cation. Accounts of Chemical Research. 1983, 16 (12): 440. doi:10.1021/ar00096a003.
- ^ 27.0 27.1 Olah, G. A. My Search for Carbocations and Their Role in Chemistry(Nobel Lecture). Angewandte Chemie International Edition in English. 1995, 34 (1314): 1393–1405. doi:10.1002/anie.199513931.
- ^ 28.0 28.1 Winstein, S.; Carter, P. The π-Route to a Bicycloöctyl Non-Classical Cation. Journal of the American Chemical Society. 1961, 83 (21): 4485. doi:10.1021/ja01482a057.
- ^ 29.0 29.1 Nenitzescu, Costin. Chapter 1: Historical Outlook. Olah, George; von Schleyer, Paul (编). Carbonium Ions. Volume I: General Aspects and Methods of Investigation. New York: Wiley-Interscience: 55–59. 1968.
- ^ Bartlett, P. D.; Sargent, G. D. Nucleophilic Reactivity of the Carbon–Carbon Double Bond. II. Solvolytic Ring Closure of 2-(3-methyl- and 3,4-dimethyl-Δ3-cyclopentenyl)ethyl p-nitrobenzenesulfonates. Journal of the American Chemical Society. 1965, 87 (6): 1297. doi:10.1021/ja01084a026.
- ^ Schleyer, P. V. R.; Watts, W. E.; Fort, R. C.; Comisarow, M. B.; Olah, G. A. Stable Carbonium Ions. X. Direct Nuclear Magnetic Resonance Observation of the 2-Norbornyl Cation. Journal of the American Chemical Society. 1964, 86 (24): 5679. doi:10.1021/ja01078a056.
- ^ Olah, G. A.; Prakash, G. K. S.; Arvanaghi, M.; Anet, F. A. L. High-Field 1H and 13C NMR Spectroscopic Study of the 2-Norbornyl Cation. Journal of the American Chemical Society. 1982, 104 (25): 7105. doi:10.1021/ja00389a037.
- ^ Leone, Ronald; Barborak, J.C.; von Schleyer, Paul. Chapter 33: Degenerate Carbonium Ions. Olah, George; von Schleyer, Paul (编). Carbonium Ions. Volume IV: Major Types (Continued). New York: Wiley-Interscience: 1911–1915. 1973.
- ^ Fry, James; Karabatsos, Gerasimos. Chapter 14: Intramolecular Hydride Shifts in Carbonium Ions. Olah, George; von Schleyer, Paul (编). Carbonium Ions. Volume II: Methods of Formation and Major Types. New York: Wiley-Interscience: 535–553. 1970.
- ^ Olah, G. A. Chemischer Informationsdienst 7 (24). 1976.
- ^ Yannoni, C. S.; Macho, V.; Myhre, P. C. Resolved 13C NMR spectra of carbonium ions at cryogenic temperatures. The norbornyl cation at 5 K. Journal of the American Chemical Society. 1982, 104 (25): 7380. doi:10.1021/ja00389a108.
- ^ Olah, G. A.; White, A. M. Stable carbonium ions. LXXXVI. Carbon-13 nuclear magnetic resonance spectrum of the stable nonclassical norbornyl cation. Incompatibility with the equilibrating classical ion conception and further proof for the protonated nortricyclene structure. Journal of the American Chemical Society. 1969, 91 (14): 3954. doi:10.1021/ja01042a053.
- ^ Olah, G. A.; Commeyras, A.; Lui, C. Y. Stable carbonium ions. LXXII. Raman and N.M.R. Spectroscopic study of the nortricyclonium ion [protonated tricyclo[2.2.1.02,6]heptane] and its relation to the 2-norbornyl [bicyclo[2.2.1]heptyl] cation. The nature of the stable long-lived norbornyl cation in strong acid solutions. Journal of the American Chemical Society. 1968, 90 (14): 3882. doi:10.1021/ja01016a062.
- ^ Radom, Leo; Poppinger, Dieter; Haddon, Robert. Chapter 38: Molecular Orbital Theory of Carbocations. Olah, George; von Schleyer, Paul (编). Carbonium Ions. Volume V: Miscellaneous Ions, Theory, and Structure. New York: Wiley-Interscience: 2390–2391. 1976.
- ^ Hoffmann, R. Extended Hückel Theory. IV. Carbonium Ions. The Journal of Chemical Physics. 1964, 40 (9): 2480–2488. Bibcode:1964JChPh..40.2480H. doi:10.1063/1.1725551.
- ^ Schleyer, P. V. R.; Chandrasekhar, J. Evaluation of the extra stability of the bridged 2-norbornyl cation. The Journal of Organic Chemistry. 1981, 46: 225–227. doi:10.1021/jo00314a065.
- ^ Brown, H. C.; Rei, M. H. Comparison of the Effect of Substituents at the 2-Position of the Norbornyl System with Their Effect in Representative Secondary Aliphatic and Alicyclic Derivatives. Evidence for the Absence of Nonclassical Stabilization of the Norbornyl Cation. Journal of the American Chemical Society. 1964, 86 (22): 5008. doi:10.1021/ja01076a058.
- ^ Bunton, C.A. Chapter 2. Structural Effects upon Rate of Substitution; Section 11. Non-classical carbonium ions. Hughes, E.D. (编). Reaction Mechanisms in Organic Chemistry. Volume I: Nucleophilic Substitution at a Saturated Carbon Atom. Amsterdam: Elsevier Publishing Company. 1963: 59–67.
- ^ Schleyer, P. V. R. The Nonclassical Carbonium Ion Problem: Reaction Rates. Journal of the American Chemical Society. 1964, 86 (9): 1856–1857. doi:10.1021/ja01063a044.
- ^ Brown, H. C.; Chloupek, F. J.; Rei, M. H. Comparison of the Rates of Solvolysis of Representative Norbornyl and Cyclopentyl Derivatives. A Critical Examination of Rates as a Basis for the Postulated Nonclassical Structure of Norbornyl Cations. Journal of the American Chemical Society. 1964, 86 (6): 1247. doi:10.1021/ja01060a059.
- ^ Brown, H. C.; Chloupek, F. J.; Rei, M. H. Rates of Solvolysis of the p-Nitrobenzoates of exo-endo' Tertiary Norborneols. A Critical Examination of the exo-endo Rate Ratio as a Basis for the Postulated Nonclassical Structure of the Norbornyl Cation. Journal of the American Chemical Society. 1964, 86 (6): 1248. doi:10.1021/ja01060a060.
- ^ Saunders, M.; Telkowski, L.; Kates, M. R. Isotopic perturbation of degeneracy. Carbon-13 nuclear magnetic resonance spectra of dimethylcyclopentyl and dimethylnorbornyl cations. Journal of the American Chemical Society. 1977, 99 (24): 8070. doi:10.1021/ja00466a060.
- ^ Saunders, M.; Kates, M. R. Isotopic perturbation of resonance. Carbon-13 nuclear magnetic resonance spectra of deuterated cyclohexenyl and cyclopentenyl cations. Journal of the American Chemical Society. 1977, 99 (24): 8071. doi:10.1021/ja00466a061.
- ^ Saunders, M.; Kates, M. R. Deuterium isotope effect on the carbon-13 NMR spectrum of the bicyclo[2.2.1]heptyl cation. Nonclassical norbornyl cation. Journal of the American Chemical Society. 1980, 102 (22): 6867. doi:10.1021/ja00542a044.
