端基异构效应
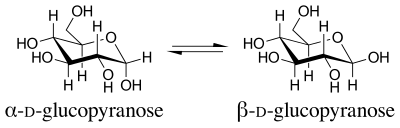
端基异构效应,也称异头效应,是立体电子效应的一种。它使具有杂环己烷环系的分子中,杂原子邻位的、含杂原子的取代基偏好占据直键,而非立体位阻上更占优势的平键[1]。此效应最初是由J. T. Edward在1955年研究糖化学时在吡喃糖环中观察到的。
端基异构效应(Anomeric effect)这个术语于1958年被提出[2]。 该名称来自用于表示吡喃糖中编号最低的环碳的一个术语,即端基碳(或异头碳)。
端基异构效应得名于端基异构现象,端基碳(或异头碳)即吡喃糖的C1。
物理解释和争议
[编辑]端基异构效应的物理原因尚未被完全理解。 多个有部分冲突的解释被提供,但是该主题仍未解决[3]。
超共轭效应
[编辑]环状分子
[编辑]一种广泛接受的解释是,杂原子(糖环中的内环一个)的孤对电子与轴向(环外)C-X键的σ*轨道之间存在稳定的相互作用(超共轭效应)。 这导致分子将供体的孤对电子(约180°)与σ*轨道对齐,从而降低了系统的整体能量,并提高了稳定性[4]。

一些作者还根据分子中原子量子理论的结果质疑这种超共轭模型的有效性[5]。 尽管大多数有关端基异构作用的研究本质上都是理论性的,但由于该假设提出的乙缩醛中电子密度的重新分布与已知的化学反应特别是单糖的化学性质不符, 因此对n–σ*(超共轭)假设也进行了广泛的批评[6][7]。
非环分子
[编辑]超共轭效应也出现在含有杂原子(异头作用的另一种形式)的无环分子中。 如果一个分子中有一原子具有孤电子对,并且相邻的原子上有未填满的σ*轨道,便可发生超共轭效应,从而稳定该分子,形成非键共振。
偶极子最小化
[编辑]端基异构效应的另一种公认解释是,赤道构型的偶極子将两个杂原子部分对齐,因此彼此排斥。相比之下,轴向配置使这些偶极子大致相对,从而代表了更稳定和更低的能量状态。

n-n排斥和C-H氢键
[编辑]如果在2-甲氧基吡喃的端基异构体中心的氧上的孤对电子被显示,则对异构体构象的简要检查表明,β-异构体始终具有至少一对遮蔽的(共面1,3- 相互作用)孤对,这种n-n排斥是高能量的情况。
合成应用
[编辑]端基异构效应被考虑合成。 由于其在糖中的发现,糖和碳水化合物化学是端基异构效应的更常见的合成用途之一。 例如,柯尼希斯-克诺尔糖苷化(Koenigs–Knorr反应)以异源效应实现高非对映选择性的α-OR或β-OR基团的安装。 槐糖脂内酯,(+)-Lepicidin A和(-)-Lisperpermoside是通过Koenigs-Knorr糖苷化克服端基异构效应而合成的一些产物[8]。

参见
[编辑]- 米氏酸
- 立体电子效应
- 邻位交叉效应(Gauche effect)
- Baldwin规则:可以通过成环的原子与化学键分子轨道之间的作用来解释。
- 伯基-丹尼兹轨道
- 分子内作用力
- 單醣
- 位阻效应(Steric effects)
参考资料
[编辑]- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (1996) "Anomeric Effect"。doi:10.1351/goldbook.A00372
- ^ Juaristi, E.; Cuevas, G. Recent studies of the anomeric effect. Tetrahedron. 1992, 48 (24): 5019–5087. doi:10.1016/S0040-4020(01)90118-8.
- ^ Chemistry World Blog » Anomeric argument. [2019-10-06]. (原始内容存档于2019-05-16).
- ^ Cuevas, Eusebio Juaristi, Gabriel. The anomeric effect. Boca Raton: CRC Press. 1995. ISBN 978-0-8493-8941-2.
- ^ Vila, A.; Mosquera, R. A. Atoms in molecules interpretation of the anomeric effect in the O—C—O unit. J. Comput. Chem. 2007, 28 (9): 1516–1530. PMID 17330885. doi:10.1002/jcc.20585.
- ^ Box, V. G. S. The role of lone pair interactions in the chemistry of the monosaccharides. The anomeric effect. Heterocycles. 1990, 31 (6): 1157–1181. doi:10.3987/REV-90-414.
- ^ Box, V. G. S. The role of lone pair interactions in the chemistry of the monosaccharides. Stereo-electronic effects in unsaturated monosaccharides. Heterocycles. 1991, 32 (4): 795–807. doi:10.3987/REV-91-425.
- ^ Kürti, László; Czakó, Barbara. Strategic applications of named reactions in organic synthesis : background and detailed mechanisms ; 250 named reactions Pbk. ed., [Nachdr.]. Amsterdam [u.a.]: Elsevier Academic Press. 2007. ISBN 978-0-12-429785-2.
