四氟化氙
外观
| 四氟化氙 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Xenon tetrafluoride | |||
| 别名 | 氟化氙(IV) | ||
| 识别 | |||
| CAS号 | 13709-61-0 | ||
| PubChem | 123324 | ||
| ChemSpider | 109927 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | RPSSQXXJRBEGEE-UHFFFAOYAW | ||
| 性质 | |||
| 化学式 | XeF4 | ||
| 摩尔质量 | 207.2836 g·mol⁻¹ | ||
| 外观 | 白色固体 | ||
| 密度 | 4.040 g/cm3 (固) | ||
| 升华条件 | 117 °C (390 K)[1] | ||
| 结构 | |||
| 配位几何 | D4h | ||
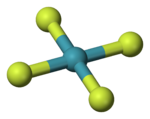
| 分子构型 | 平面正方形 | ||
| 偶极矩 | 0 D | ||
| 危险性 | |||
| 闪点 | ? °C | ||
| 相关物质 | |||
| 相关化学品 | 二氟化氙、六氟化氙 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
四氟化氙(化学式:XeF4)是稀有气体氙的氟化物之一,是第一个发现的稀有气体二元化合物。[2]
製造
[编辑]- 首次制备的方法:由Xe与F2以1:2摩尔比反应得到。[3][4]该反应是放热反应,每摩尔反应放出251kJ的热量。[2]
- 放电合成法:将氙与氟按体积比1:2加入反应容器(温度需控制在-78℃),放电条件为1100V、31mA到2800V、12mA,反应历时3小时。电压不能太高否则氙与氟发生燃烧反应。为了主要获得四氟化氙,氟需要略微过量。
- 二氟化二氮氟化法:在200℃以下将二氟化二氮与氙共热,主要得到四氟化氙。该法可以避免使用危险且难以制备的氟单质。
物理性质
[编辑]四氟化氙是一种无色固体,室温下易升华。四氟化氙微溶于无水氟化氢,但并不电离。它不溶于全氟庚烷中,但可溶于NOF·3HF。[5]
结构
[编辑]1963年核磁共振谱与X射线晶体学数据显示其四氟化氙的空间构型为平面正方形。[6][7]四氟化氙为体心单斜晶系,X射线衍射法和中子衍射法测得Xe-F键键长约为190pm。
化学性质
[编辑]四氟化氙在室温下稳定,可以长期储存在镍制容器中,如果去除水和氟化氢也可保存在玻璃容器中。
- 它能被氢气还原,该反应可用于分析鉴定:
- 这个反应机理很复杂,Xe(IV)先发生歧化反应得到Xe(0)和Xe(VI),然后分别氧化水并放出氧气。
- 它在撞击或震动下都很稳定,不会爆炸性分解。但与有机物(例如四氢呋喃、二氧六环、丙酮、乙烯)接触时会剧烈反应而引起燃烧。如果与气态的乙醇或丙酮反应将发生爆炸。
- 氟磺酸中的-OSO2F是电负性很高的基团,可取代四氟化氙中的氟原子形成衍生物:
- 但后来化学家再次进行该实验时,只得到了二氟化氙的衍生物。这可能是过去使用的四氟化氙不纯造成的。[5]
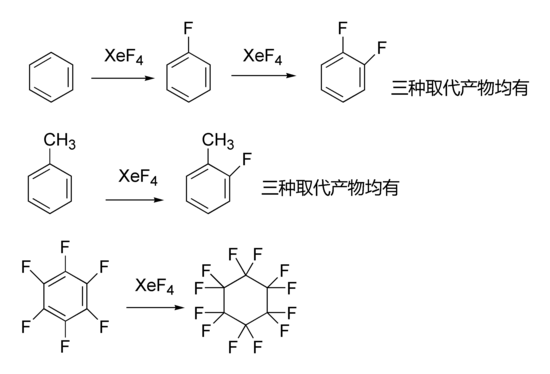
- 以下是四氟化氙参与的有机反应:
参考资料
[编辑]- ^ Holleman, Arnold F.; Wiberg, Egon. Wiberg, Nils , 编. Inorganic Chemistry. 由Eagleson, Mary; Brewer, William翻译. Academic Press. 2001: 394. ISBN 0-12-352651-5.
- ^ 2.0 2.1 Zumdahl. Chemistry. : 243. ISBN 0-618-52844-X.
- ^ Claassen, H. H.; Selig, H.; Malm, J. G. Xenon Tetrafluoride. J. Am. Chem. Soc. 1962, 84 (18): 3593. doi:10.1021/ja00877a042.
- ^ C. L. Chernick, H. H. Claassen, P. R. Fields 1, H. H. Hyman, J. G. Malm, W. M. Manning, M. S. Matheson, L. A. Quarterman, F. Schreiner, H. H. Selig, I. Sheft, S. Siegel, E. N. Sloth, L. Stein, M. H. Studier, J. L. Weeks, and M. H. Zirin. Fluorine Compounds of Xenon and Radon. Science. 1962, 138 (3537): 136–138. PMID 17818399. doi:10.1126/science.138.3537.136.
- ^ 5.0 5.1 5.2 5.3 张青莲. 《无机化学丛书》第一卷:稀有气体、氢、碱金属. 北京: 科学出版社. 1991年11月: P45–51. ISBN 7-03-002238-6.
- ^ Thomas H. Brown, E. B. Whipple, and Peter H. Verdier. Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum. Science. 1963, 140 (3563): 178. PMID 17819836. doi:10.1126/science.140.3563.178.
- ^ James A. Ibers and Walter C. Hamilton. Xenon Tetrafluoride: Crystal Structure. Science. 1963:, 139 (3550): 106–107. PMID 17798707. doi:10.1126/science.139.3550.106.