铬酰氟
| 铬酰氟 | |
|---|---|
| |
| IUPAC名 Difluoro(dioxo)chromium | |
| 别名 | 二氟二氧化铬 |
| 识别 | |
| CAS号 | 7788-96-7 |
| PubChem | 53471881 |
| ChemSpider | 10329781 |
| SMILES |
|
| InChI |
|
| InChIKey | FRLBLFFATGQISB-UNDMLHRZAG |
| EINECS | 232-137-9 |
| 性质 | |
| 化学式 | CrF2O2 |
| 摩尔质量 | 121.99 g·mol−1 |
| 外观 | 紫色晶体 |
| 熔点 | 31.6 °C(305 K) |
| 沸点 | 30 °C(303 K)(升华[1]) |
| 结构 | |
| 晶体结构 | 单斜 |
| 空间群 | P21/c, No. 14 |
| 危险性 | |
| 主要危害 | 氧化剂 |
| 相关物质 | |
| 相关化学品 | 铬酰氯 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
铬酰氟是一种无机化合物,化学式 CrO2F2。它是一种紫红色晶体(也有文献报道为橙色晶体[2]),液态时为红橙色。[3]
结构
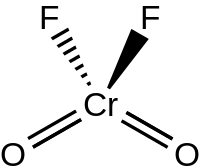
[编辑]液态和气态的 CrO2F2 都是四面体型的,对称群 C2v,这类似于铬酰氯。[4]铬酰氟在固态下二聚成含有桥接氟的二聚体(O2Cr(μ-F)4CrO2),空间群 P21/c。其中的 Cr=O 键长为 157 pm,Cr–F 键长则为 181.7、186.7和209.4 pm。铬是六配位的,为扭曲八面体型结构。[5]
历史和制备
[编辑]纯铬酰氟于 1952年首次分离,由Alfred Engelbrecht和Aristid von Grosse报告。[6]在19世纪早期,加热萤石、铬酸盐和硫酸的混合物时,它首次以红色蒸汽的形式被观察到。这些红色蒸汽最初被认为是CrF6,尽管一些化学家认为这是结构类似 CrO2Cl2的CrO2F2。[6]Fredenhagen 研究氟化氢与碱金属铬酸盐的反应,第一次成功合成铬酰氟。后来,von Wartenberg 通过用氟气处理铬酰氯来制备不纯的 CrO2F2。[7]Wiechert进行了另一次尝试,它在 -40℃下用HF处理重铬酸盐,产生不纯的CrO2F2液体。
Engelbrecht 和von Grosse的CrO2F2制备方法包括三氧化铬被氟化剂氟化:[6]
- CrO3 + 2 HF → CrO2F2 + H2O
这个反应是可逆的,水会重新把 CrO2F2水解成CrO3。
- CrO3 + 2 ClF → CrO2F2 + Cl2 + O2
- CrO3 + COF2 → CrO2F2 + CO2
- CrO3 + MF6 → CrO2F2 + MOF4 (M = Mo, W)
最后一种方法涉及钨和钼的六氟化物。据Green和Gard报道,该方法是获得大量纯CrO2F2非常简单和有效的途径。[3]在120 °C下,产率是100%。正如从MoF6和WF6的相对反应性所预期的那样,六氟化钼的反应比六氟化钨更容易进行。[8]
反应
[编辑]铬酰氟是一种强氧化剂,可以把烃氧化成酮或羧酸。它也可以用来制备其它铬酰化合物。[3]类似其它氟化物,CrO2F2 与玻璃和石英反应,因此需要无硅塑料或金属容器来处理它。它在无机系统中的氧化性也已被探索。[9]铬酰氟可以和金属氧化物反应:
- CrO2F2 + MO → MF2 + CrO3
铬酰氟也会把硼和硅的氧化物变成氟化物。[9]
在全氟庚烷溶剂中,铬酰氟会于碱金属和碱土金属的氟化物,产生橙色的氟铬酸盐:[9]
- CrO2F2 + 2 MF → M2CrO2F4
铬酸氟和路易斯酸反应,从酸酐中得到羧基类配体并产生酰氟副产物:[9]
- CrO2F2 + 2 (CF3CO)2O → CrO2(CF3COO)2 + 2 CF3COF
参考资料
[编辑]- ^ Brauer, Georg. Chromyl Fluoride – CrO
2F
2. Handbook of Preparative Inorganic Chemistry, Volume 1 2nd. Stuttgart; New York: Ferdinand Enke Verlag; Academic Press, Inc. 1963: 258–259 [1960] [2021-07-24]. ISBN 978-0-32316127-5. (原始内容存档于2021-08-27). - ^ Hubert Schmidbaur, W. H. Eugen Schwarz. Permanganyl Fluoride: A Brief History of the Molecule MnO 3 F and of Those Who Cared For It. Chemistry – A European Journal. 2021-04-21, 27 (23): 6848–6859 [2022-06-27]. ISSN 0947-6539. PMC 8247864
 . PMID 33219726. doi:10.1002/chem.202004759 (英语).
. PMID 33219726. doi:10.1002/chem.202004759 (英语).
- ^ 3.0 3.1 3.2 Gard, G. L. (1986) "Chromium Difluoride Dioxide (Chromyl Fluoride)," Inorg. Synth., 24, 67-69, doi:10.1002/9780470132555.ch20.
- ^ Hobbs, W. E. (1958) "Infrared Absorption Spectra of Chromyl Fluoride and Chromyl Chloride," J. Chem. Phys. 28(6), 1220-1222, doi:10.1063/1.1744372.
- ^ Supeł, J.; Abram, U.; Hagenbach, A.; Seppelt, K. (2007) "Technetium Fluoride Trioxide, TcO3F, Preparation and Properties." Inorg. Chem., 46(14), 5591–5595, doi:10.1021/ic070333y.
- ^ 6.0 6.1 6.2 Engelbrecht, A.; von Grosse, A. (1952) "Pure Chromyl Fluoride," J. Am. Chem. Soc. 74(21), 5262–5264, doi:10.1021/ja01141a007.
- ^ von Wartenberg, H. (1941) "Über höhere Chromfluoride (CrF
4, CrF
5 und CrO
2F
2)" [About higher chromium fluorides (CrF
4, CrF
5 and CrO
2F
2)], Z. Anorg. Allg. Chem. [in German], 247(1-2), 135–146, doi:10.1002/zaac.19412470112. - ^ Green, P. J.; Gard, G. L. (1977) "Chemistry of Chromyl Fluoride. 5. New Preparative routes to CrO2F2," Inorg. Chem. 16(5), 1243–1245, doi:10.1021/ic50171a055.
- ^ 9.0 9.1 9.2 9.3 Brown, S. D.; Green, P.J.; Gard, G.L. (1975) "The Chemistry of Chromyl Fluoride III: Reactions with Inorganic Systems," J. Fluorine Chem. 5(3), 203-219, doi:10.1016/S0022-1139(00)82482-3.
