氫鍵催化

氫鍵催化是一種依賴於氫鍵相互作用加速和控制有機反應的有機催化。生物系統中,無論是在底物分子的定向還是在降低反應壁壘方面,氫鍵在諸多酶促反應里都起着關鍵的作用。 [1]而化學方面直到最近才開始嘗試利用氫鍵進行催化,與路易斯酸催化的研究相比,該領域尚且不發達。 [2]
催化劑量的氫鍵供體可以通過多種不同的機制促進反應。反應過程中,氫鍵可用於穩定陰離子中間體和過渡態。一些催化劑可以結合較小的陰離子,從而形成反應性的親電陽離子。酸性更強的供體可以作為一般酸或特定酸,通過質子化激活親電試劑。一種強有力的方法是同時激活反應中的兩個部分,如親核試劑和親電試劑,稱之為「雙功能催化」。這些情況下催化劑分子與底物的緊密結合也使氫鍵催化成為一種強大的誘導對映選擇性的方法。
氫鍵催化劑通常製造簡單,相對穩健,並且可以以高對映體純度合成。由氫鍵供體催化的新反應正越來越快被發現,包括合成常見有機反應的不對稱變體,例如醛醇加成、 Diels-Alder環加成和Mannich反應等。 [3]
然而,氫鍵催化在合成效用方面發揮全部潛力之前,也面臨幾個挑戰。當前已知的反應非常特定於底物的並且通常表現出低速率,因此需要高催化劑負載量。催化劑往往通過反覆試驗和優化,化學家對催化劑結構與反應性之間的關係了解甚少。此外,該領域中,新反應的發現已經遙遙領先於對於機理的一般理解。隨着未來對結構和機理的更詳細研究,氫鍵催化在實現新的、高效的、選擇性的反應和不對稱合成中的應用方面具有巨大潛力。
催化策略
[編輯]四面體中間體的穩定
[編輯]許多有機反應通過對醛、酰胺或亞胺等官能團親核攻擊而形成四面體中間體。在這些情況下適合使用氫鍵供體進行催化,因為陰離子四面體中間體相比原始的化合物更容易形成氫鍵。對於最初的催化劑-底物複合物,帶有更多負電荷的過渡態更加穩定。

例如在典型的酰基取代反應中,起始的羰基化合物通過一個、兩個或以上的氫鍵與催化劑配位。在親核試劑攻擊的過程中,負電荷集中在氧上,直至形成四面體中間體。由於負電荷增加,形式上的負氧比剛開始羰基的氧可以形成更強的氫鍵。在能量上,催化劑降低中間態和過渡態的能量,從而加速反應。
這種催化模式存在於絲氨酸蛋白酶等許多酶的活性位點。[4]例如在這反應中,酰胺的羰基與兩個N-H供體配位。這些促進生物學中羰基反應的多重配位位點被稱為「負氧離子洞」。絲氨酸親核試劑促進形成四面體中間體,其通過增加與負氧離子洞的氫鍵鍵合而穩定下來。

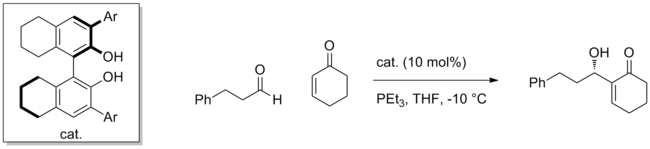
許多合成催化劑成功利用這種策略激活親電試劑。例如使用手性的聯萘酚可以高對映選擇性地進行烯酮加成到醛上的貝里斯-希爾曼反應。 [5]親核試劑由 PEt 3與烯酮共軛加成產生的烯醇化物,對映選擇性地加成與催化劑配位的醛。
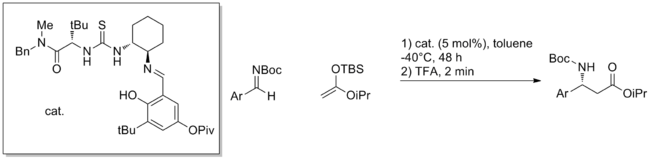
除羰基外,如亞胺的其他親電試劑也得到應用。例如,使用簡單的手性硫脲催化劑,芳族亞胺與甲硅烷基乙烯酮縮醛的不對稱曼尼希反應可以以高ee近乎定量轉化。 [6]該反應的機理尚未完全闡明,並且該反應具有很強的底物特異性,僅對某些芳香族親電子試劑有效。
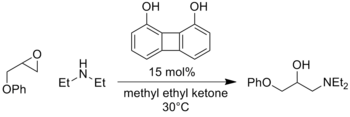
這種活化模式廣泛適用,關於親電試劑、親核試劑和催化劑結構的不同組合的新報道紛至沓來。此外,該策略也可以成功催化氧陰離子中間體的類似反應,例如亞硝基化合物中的烯醇化物的加成[7]或環氧化物的開環[8] 。
儘管已知的不同反應眾多,對催化模式的理解有限,並且幾乎所有催化反應的底物特異性都極強。
陰離子的穩定
[編輯]另一種已知的策略是穩定過渡態產生的部分負電荷。反應過程中一個片段產生部分電負性,過渡態通過接受氫鍵而穩定。
Jacobsen組報道了酯取代烯丙基乙烯基醚的Claisen 重排催化。 [9]手性胍催化劑成功促進了接近室溫的反應,具有高對映選擇性。過渡態與脒鎓催化劑配位的片段由於氧的電負性和吸電子酯基團而表現出部分陰離子特性,增加了氫鍵的強度並降低了過渡態能量,從而加速反應。

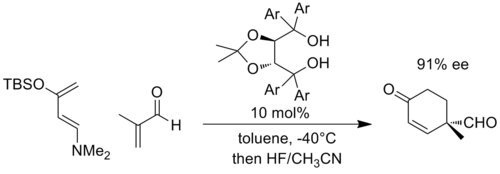
而且,諸如Diels-Alder反應的環加成反應中也可以通過負電荷的穩定達到。例如,Rawal等人開發了一種基於α,α,α,α-四芳基-1,3-二氧戊環-4,5-二甲醇 ( TADDOL ) 的手性催化劑,可以催化Diels-Alder反應。在下面的例子中,與高度富電子的雙烯和貧電子的親雙烯體的反應可能在烯醇上產生顯着的負電荷,並且過渡態通過增加與 TADDOL的氫鍵來穩定(Ar =1-萘基)。 [10]
陰離子結合
[編輯]氫鍵催化劑還可以通過吸附和/或配位諸如鹵化物的陰離子,形成親電物質來加速反應。尿素和硫脲催化劑是通過結合陰離子催化最常見的供體,它們結合鹵化物和其他陰離子的能力已經得到充分證實。 [11]手性陰離子結合催化劑可以產生不對稱的離子對,誘導反應的立體選擇性。
通過陰離子結合催化的第一個反應是在硫脲催化下羥基內酰胺與TMSCl的皮克特-施彭格勒環化。[12]機理中羥基被氯化物取代後,形成了關鍵的離子對。手性硫脲通過亞胺與氯化物緊密結合,高立體選擇性形成分子內環化。
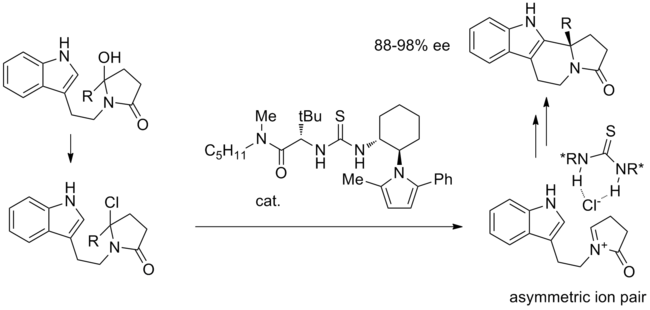
不對稱離子對也可能在分子間反應中受到攻擊。例如烯醇硅烷親核試劑與氧代碳鎓離子的不對稱加成可以通過陰離子結合催化形成氧代碳鎓實現。 [13]乙縮醛開始,氯醚與三氯化硼生成並與烯醇硅烷和催化劑反應。氧代碳鎓-硫脲-氯化物絡合物的形成機理尚未完全解決。在該反應條件下,氯醚可以差向異構化,而硫脲可以立體選擇性地結合氯化物,形成緊密締合的離子對。該不對稱離子對之後收到硅烷攻擊產生烷基化產物。

陰離子結合機制的另一個例子是下圖所示的由Jacobsen的酰胺基硫脲催化劑催化亞胺氫氰化反應。該反應是通過計算、光譜、標記以及動力學研究最廣泛的反應之一。 [14]雖然考慮了將氰化物直接添加到催化劑結合的亞胺中,但計算出另一種機制,包括形成亞胺-氰化物離子對,其勢壘可以低 20 kcal/mol。提出的最可能的機制始於催化劑與 HNC 的結合,HNC 與HCN處於平衡狀態。然後該複合物使亞胺分子質子化,形成亞胺-氰化物離子對,催化劑結合併穩定氰化物陰離子。亞胺鎓也被認為與催化劑分子上的酰胺羰基相互作用(見下文雙功能催化)。結合的氰化物陰離子旋轉,通過碳攻擊亞胺。研究人員儘管通過光譜學觀察到亞胺-尿素結合併得到早期動力學實驗的支持,但亞胺結合是非循環的,所有證據都指向這種涉及硫脲結合氰化物的機制。

質子化
[編輯]氫鍵催化和一般酸催化通常情況下很難區分。 [3]氫鍵供體可以具有不同的酸度,從弱到強的布侖斯惕-勞里酸,如磷酸。測定反應過程中質子轉移的程度具有挑戰性,並且大多數反應尚未得到徹底的研究。然而,強酸催化劑通常與氫鍵催化劑歸為一類,因為其代表連續體的一個極端情況,並且兩者的催化行為也有相似之處。這些反應的活化機制涉及親電子物質的初始質子化,使底物更具親電性並產生離子對,通過該離子對可以傳輸立體化學信息。

底物幾乎完全質子化的不對稱催化在芳族醛亞胺與碳親核試劑的曼尼希反應中有效。 [15]此外,呋喃氮雜傅-克反應、重氮羰基化合物的酰胺烷基化、醛亞胺的不對稱氫膦酰化以及轉移氫化都有報道。 [3]手性布朗斯台德酸通常很容易從手性醇(如 BINOL)製備,並且由於它們在分子研究中已確立的實用性,文獻中也有報道。 [16]
多功能策略
[編輯]氫鍵催化的主要優點之一是能夠構建參與多種非共價相互作用以促進反應的催化劑。除了在反應過程中使用氫鍵供體激活或穩定反應中心外,還可以引入其他官能團,例如路易斯鹼、芳烴或加成氫鍵位點,以提供額外的穩定性或影響其他反應伴侶。
例如,天然酶雙功能酶分支酸變位酶催化分支酸的克萊森重排,除了參與穩定烯醇化物樣片段的氫鍵外,還具有許多其他相互作用,這是上面討論的陰離子片段穩定策略的一個例子。 [17]一個關鍵的相互作用是通過過渡態的陽離子-π相互作用穩定另一個陽離子烯丙基。使許多額外的氫鍵有幾個可能目標。多個氫鍵與酶的穩定有助於克服結合的熵成本。此外,相互作用有助於將底物保持在反應性構象中,並且酶催化反應的活化熵接近於零,而溶液中典型的克萊森重排具有非常負的活化熵。

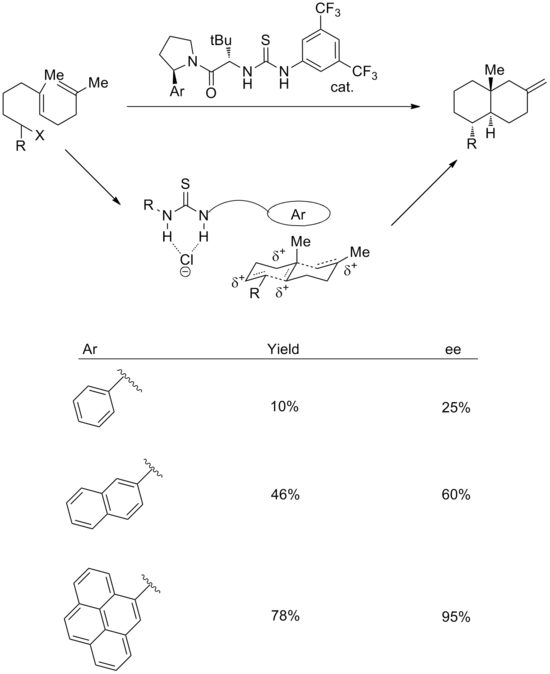
陽離子-π相互作用的使用也已成功地應用於合成催化劑的反應中。陰離子結合和陽離子π策略的組合可用於實現對映選擇性陽離子多環化。[18]在過渡態,可能機理為硫脲基團結合氯,而芳香族系統穩定相關的多烯陽離子。支持這一點的是,增加芳環的大小可提高產率和立體選擇性。對映選擇性與芳基的極化率和四極矩密切相關。
由於如此大量的催化劑和反應涉及與親電子試劑結合以穩定過渡態,因此許多雙功能催化劑還存在路易斯鹼性氫鍵受體位點。作為一個代表性的例子,Deng等人開發了一種能夠促進立體選擇性邁克爾反應的硫脲-胺催化劑。 [19]在可能的過渡態中,其中一個硫脲 N-H 供體與邁克爾受體配位,並將穩定負電荷的積累。鹼性孤對氮作為氫鍵受體配位親核試劑,但在過渡態作為一般鹼基促進親核烯醇加成。

這種讓親核和親電夥伴參與反應並將它們穩定在過渡態,常見於硫脲有機催化文章中。
使用合成寡肽進行催化的一種相對較新的策略已經產生了許多成功的催化方法。[20]肽具有多個潛在的氫鍵位點,通常不了解這些位點如何與底物結合或如何促進反應。肽具有高度模塊化的優勢,並且通常在大型陣列中篩選這些催化劑。以這種方式已經發現了高度對映選擇性的反應,例如下面描述的羥醛反應。
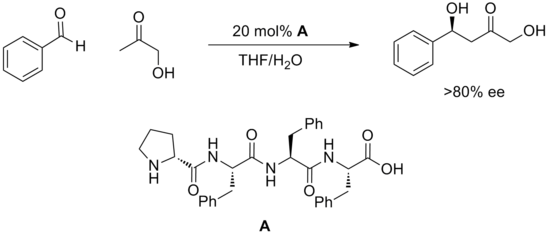
合成肽成功催化的其他轉化包括氫氰化、酰化、共軛加成、醛-亞胺偶聯、羥醛反應和溴化。雖然過渡態的性質尚不清楚,但在許多例子中,催化劑結構的微小變化對反應活性有顯著影響。據推測,肽內以及催化劑與底物之間的大量氫鍵必須合作以滿足成功催化的幾何要求。除此之外,對催化劑設計和機制的理解還沒有超出需要測試肽庫的範圍。
催化劑設計
[編輯]優選結構
[編輯]催化中使用的氫鍵供體類型因反應而異,即使在相似的催化策略中也是如此。雖然特定係統經常被廣泛研究和優化,但對反應的最佳供體或催化劑結構與反應性之間的關係的一般理解卻非常缺乏。合理設計結構以促進具有所需選擇性的所需反應尚不切實際。然而,當代氫鍵催化主要集中在少數幾種系統上,這些系統在實驗上似乎在各種情況下都有效。 [21]這些被稱為「優選結構」。然而,值得注意的是,其他結構支架和圖案也顯示出有希望的結果,例如金屬配位的氫鍵供體。 [22]
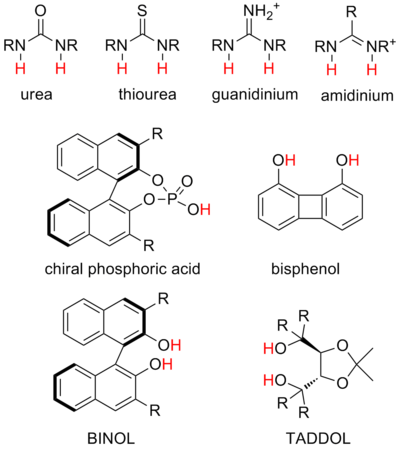
- 脲和硫脲是迄今為止最常見的結構,可以穩定多種帶負電荷的中間體,並參與陰離子結合催化。雙功能尿素和硫脲催化常見於文獻中。
- 胍和脒離子與脲和硫脲結構類似,可以催化類似的反應,但由於它們的正電荷,它們是更強的供體並且酸性更強。胍和脒催化的機制被認為通常涉及底物的部分質子化。
- 人們認為二醇催化劑通過單個氫鍵與底物結合,而另一個羥基則參與內部氫鍵。這些是最早研究的一些氫鍵催化劑。它們最常用於穩定過渡態的部分陰離子電荷,例如在異-Diels-Alder 反應中與醛親二烯體配位。
- 磷酸催化劑是最常見的強酸催化劑,通過與亞胺等鹼性底物形成手性離子對起作用。
催化劑調整
[編輯]一般來說,供體部位的酸度與供體的強度密切相關。例如,在硫脲催化劑上添加吸電子芳基取代基是一種常見的策略,這可以增加其酸性,從而增加其氫鍵強度。然而,目前尚不清楚供體強度與所需反應性之間的關係。重要的是,更多的酸性催化劑不一定更有效。例如,尿素的酸性比硫脲低大約 6 個 pKa 單位,但通常來說尿素的催化反應要差得多。 [23]
此外,人們很少了解不同取代基對催化劑的影響。小的取代基變化可以完全改變反應性或選擇性。這方面的一個例子是雙功能 Strecker 反應催化劑的優化研究,它是最早得到充分研究的硫脲催化劑之一。 [24]具體來說,改變水楊醛亞胺取代基上的 X 取代基,發現典型的吸電子或給電子取代基對速率影響很小,但酯取代基如乙酸酯或新戊酸酯似乎會引起明顯的速率加速。鑑於 X 基團在反應過程中遠離反應中心,並且電子學似乎不是原因,因此很難合理化這一觀察結果。總的來說,儘管使用有機催化劑進行電子調諧相對容易,但化學家尚未對這些修飾形成有用的理解。
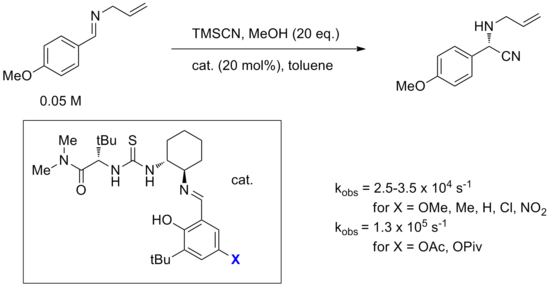
合成應用
[編輯]天然產物合成
[編輯]迄今為止,儘管發現了大量反應,但在天然產物的合成中很少有氫鍵催化的例子。通常,由於需要高催化劑負載和通常極端的底物特異性,氫鍵催化尚未發展到足以提供有用的一般反應,這些反應代表了對傳統方法的顯著改進。在已發表工作中,氫鍵催化主要用於起始階段,以快速獲得對映體富集度高的早期中間體。
在 (+)-yohimbine 的 Jacobsen 合成中, [25]一種吲哚生物鹼,使用吡咯取代的硫脲催化劑的早期對映選擇性 Pictet-Spengler 反應以 94% ee 和 81% 產率產生克級產物。合成的其餘部分很短,使用還原胺化和分子內 Diels-Alder 反應。

2008 年,Takemoto 公開了 (−)-epibatidine 的簡明合成,過程依賴於由雙功能催化劑催化的邁克爾級聯。 [26]在對β-硝基苯乙烯進行初始不對稱邁克爾加成後,分子內邁克爾加成提供 75% ee 的環酮酯產物。標準官能團操作和分子內環化產生天然產物。

構建區塊的可擴展合成
[編輯]除了全合成,氫鍵催化的一個潛在有用的應用是難以獲得的手性小分子的批量合成。一個值得注意的例子是 2009 年自然雜誌報導的使用硫脲催化的克級斯特雷克氨基酸合成反應非天然氨基酸。 [27]催化劑,無論是聚合物結合的還是均相的,都來源於天然的叔亮氨酸,可催化(4 mol% 催化劑負載)由二苯甲基胺和 HCN 水溶液形成 Strecker 產物。腈水解和脫保護以 84% 的總產率和 99% ee 產生純非天然叔亮氨酸。
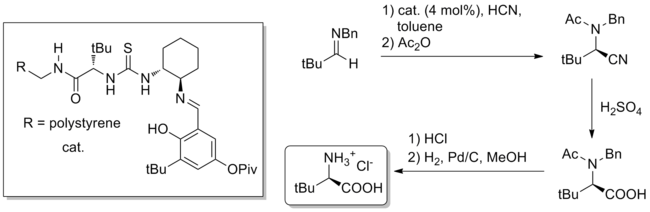
挑戰和展望
[編輯]儘管人們對有機催化有著廣泛的興趣,並且不斷發現大量新的催化體系,但在氫鍵催化領域對機理和催化劑設計的理解進展極為有限。與鈀催化偶聯反應等更發達的領域相比,氫鍵催化提出了許多尚未成功解決的挑戰。
- 劑量:雖然鈀催化反應通常在催化劑負載量小於 0.1 mol %可有效,氫鍵催化劑的加入量往往大於10 mol %。速率加速不良是一個普遍趨勢,必須克服這一趨勢才能使氫鍵催化成為一種實用的合成策略。
- 機制:未來,需要進一步研究氫鍵催化機制中涉及的精確步驟,這將使化學家能夠合理地設計催化策略以實現更複雜或更有用的轉化。相比之下,鈀催化交叉偶聯的基本步驟在過去幾十年中得到了系統和深入的研究,並在催化範圍、控制和反應設計原則方面取得了巨大進步。例如,對氧化加成的深入了解使芳基氯成為實用的偶聯劑,而對還原消除的深入了解則促進了涉及 sp3中心的新反應的發展。了解這些基本的催化步驟,合理規劃新反應和級聯的能力在全合成領域非常有用。相比之下,我們缺乏對氫鍵催化步驟以及如何影響它們的一般、系統的機制理解。到目前為止,詳細的機理研究僅限於單個系統,他們的發現還沒有可證明的預測用途。
- 催化:一個相關的挑戰是研究如何使用催化劑、結構、構象和電子的變化來合理地影響反應。目標是充分了解如何使用多種合作相互作用來最好地加速反應並賦予選擇性。理想情況下,合理的催化劑設計最終將取代對催化劑家族的篩選,並且結構單元的選擇將變得更加系統化。
- 普適性:雖然新反應不斷被發現,但大多數反應的底物範圍都非常狹窄,而且範圍如此狹窄的原因往往不為人所知。在鈀催化領域,在建立了機理理解的基礎後,反應範圍迅速擴大。了解影響每個催化步驟的因素使化學家能夠設想和追求具有高合成效用的新反應,例如 CH 鍵活化反應。在氫鍵催化領域,化學家尚未達到可以輕鬆、系統地確定新型反應性的階段。在這一點上,反應發現是有用的,但需要更詳細的機理研究才能充分發揮氫鍵催化的潛力。
相關
[編輯]參考
[編輯]- ^ Jacobsen, E. N.; Knowles, R. R. Attractive noncovalent interactions in asymmetric catalysis: Links between enzymes and small molecule catalysts (PDF). Proc. Natl. Acad. Sci. September 2010, 107 (48): 20678–20685 [2023-05-23]. Bibcode:2010PNAS..10720678K. PMC 2996434
 . PMID 20956302. doi:10.1073/pnas.1006402107. (原始內容存檔 (PDF)於2023-01-06).
. PMID 20956302. doi:10.1073/pnas.1006402107. (原始內容存檔 (PDF)於2023-01-06).
- ^ Jacobsen, E. N.; Taylor, M. S. Asymmetric catalysis by chiral hydrogen-bond donors. Angew. Chem. Int. Ed. February 2006, 45 (10): 1521–1539. PMID 16491487. doi:10.1002/anie.200503132.
- ^ 3.0 3.1 3.2 Doyle, Abigail G.; Jacobsen, E. N. Small-molecule H-bond donors in asymmetric catalysis. Chem. Rev. December 2007, 107 (12): 5713–5743. PMID 18072808. doi:10.1021/cr068373r.
- ^ Sinnott, M. Comprehensive Biological Catalysis, Vol. 1. London: Academic Press. 1998: 345–379.
- ^ McDougal, N. T.; Shaus, S. E. Asymmetric Morita−Baylis−Hillman reactions catalyzed by chiral Brønsted acids. J. Am. Chem. Soc. September 2003, 125 (40): 12094–12095. PMID 14518986. doi:10.1021/ja037705w.
- ^ Wenzel, A. G.; Jacobsen, E. N. Asymmetric catalytic Mannich reactions catalyzed by urea derivatives: enantioselective synthesis of β-aryl-β-amino acids. J. Am. Chem. Soc. 2002, 124 (44): 12964–12965. PMID 12405820. doi:10.1021/ja028353g.
- ^ Yamamoto, H.; Momiyama, N. Bronsted acid catalysis of achiral enamines for regio- and enantioselective nitroso aldol Synthesis. J. Am. Chem. Soc. September 2004, 127 (4): 1080–1081. PMC 1460970
 . PMID 15669829. doi:10.1021/ja0444637.
. PMID 15669829. doi:10.1021/ja0444637.
- ^ Hine, J.; Linden, S. M.; Kanagasabapathy, V. M. Double-hydrogen-bonding catalysis of the reaction of phenyl glycidyl ether with diethylamine by 1,8-biphenylenediol. J. Org. Chem. December 1985, 50 (25): 5096–5099. doi:10.1021/jo00225a021.
- ^ Uyeda, C.; Jacobsen, E. N. Enantioselective Claisen rearrangements with a hydrogen-bond donor catalyst. J. Am. Chem. Soc. July 2008, 130 (29): 9228–9229. PMC 2547484
 . PMID 18576616. doi:10.1021/ja803370x.
. PMID 18576616. doi:10.1021/ja803370x.
- ^ Rawal, Viresh H.; Thadani, A.N.; Stankovich, A.R. Enantioselective Diels-Alder reactions catalyzed by hydrogen bonding. PNAS. 2004, 101 (16): 5846–5850. Bibcode:2004PNAS..101.5846T. PMC 395998
 . PMID 15069185. doi:10.1073/pnas.0308545101.
. PMID 15069185. doi:10.1073/pnas.0308545101.
- ^ Schmidtchen, F. P.; Berger, M. Artificial organic host molecules for anions. Chem. Rev. August 1997, 97 (5): 1609–1646. PMID 11851460. doi:10.1021/cr9603845.
- ^ Raheem, I. T.; Thiara, P. S.; Peterson, E. A.; Jacobsen, E. N. Enantioselective Pictet-Spengler-type Cyclizations of Hydroxylactams: H-Bond Donor Catalysis by Anion Binding. J. Am. Chem. Soc. August 2007, 129 (44): 13404–13405. PMID 17941641. doi:10.1021/ja076179w.
- ^ Reisman, S. E.; Doyle, A. G. Enantioselective thiourea-catalyzed additions to oxocarbenium ions. J. Am. Chem. Soc. May 2008, 130 (23): 7198–7199. PMC 2574628
 . PMID 18479086. doi:10.1021/ja801514m.
. PMID 18479086. doi:10.1021/ja801514m.
- ^ Zuend, S. J.; Jacobsen, E. N. Mechanism of amido-thiourea catalyzed enantioselective imine hydrocyanation: transition state stabilization via multiple non-covalent interactions. J. Am. Chem. Soc. September 2009, 131 (42): 15358–15374. PMC 2783581
 . PMID 19778044. doi:10.1021/ja9058958.
. PMID 19778044. doi:10.1021/ja9058958.
- ^ Uraguchi, D.; Terada, M. Chiral Brønsted acid-catalyzed direct Mannich reactions via electrophilic activation. J. Am. Chem. Soc. April 2004, 126 (17): 5356–5357. PMID 15113196. doi:10.1021/ja0491533.
- ^ Jansen, A. C. A.; Brussee, J. A highly stereoselective synthesis of s(−)-[1,1'-binaphthalene]-2,2'-diol. Tetrahedron Lett. May 1983, 24 (31): 3261–3262. doi:10.1016/S0040-4039(00)88151-4.
- ^ Lee, A.; Stewart, J. D.; Clardy, J.; Ganem, B. New insight into the catalytic mechanism of chorismate mutases from structural studies. Chemistry & Biology. April 1995, 2 (4): 195–203. PMID 9383421. doi:10.1016/1074-5521(95)90269-4
 .
.
- ^ Knowles, R. R.; Lin, S.; Jacobsen, E. N. Enantioselective thiourea-catalyzed cationic polycyclizations. J. Am. Chem. Soc. April 2010, 132 (14): 5030–5032. PMC 2989498
 . PMID 20369901. doi:10.1021/ja101256v.
. PMID 20369901. doi:10.1021/ja101256v.
- ^ Wang, B.; Wu, F.; Wang, Y.; Liu, X.; Deng, L. Control of diastereoselectivity in tandem asymmetric reactions generating nonadjacent stereocenters with bifunctional catalysis by Cinchona alkaloids. J. Am. Chem. Soc. January 2007, 129 (4): 768–769. PMID 17243806. doi:10.1021/ja0670409.
- ^ Wennemers, Helma. Asymmetric catalysis with peptides. Chem. Commun. 2011, 47 (44): 12036–12041. PMID 21993353. doi:10.1039/C1CC15237H.
- ^ Dalko, P. I. Enantioselective organocatalysis. Weinheim: Wiley-VCH. 2007. ISBN 978-3-527-31522-2.
- ^ Xu, Weici; Arieno, Marcus; Löw, Henrik; Huang, Kaifang; Xie, Xiulan; Cruchter, Thomas; Ma, Qiao; Xi, Jianwei; Huang, Biao; Wiest, Olaf; Gong, Lei. Metal-Templated Design: Enantioselective Hydrogen-Bond-Driven Catalysis Requiring Only Parts-per-Million Catalyst Loading. Journal of the American Chemical Society. 2016-07-20, 138 (28): 8774–8780. ISSN 0002-7863. PMC 8103658
 . PMID 27336458. doi:10.1021/jacs.6b02769 (英語).
. PMID 27336458. doi:10.1021/jacs.6b02769 (英語).
- ^ Schreiner, Peter R. Metal-free organocatalysis through explicit hydrogen-bonding interactions. Chem. Soc. Rev. 2003, 32 (5): 289–296. PMID 14518182. doi:10.1039/B107298F.
- ^ Jacobsen, E. N. Asymmetric catalysis with chiral H-bond donors (PDF). [2012-12-18].
- ^ Jacobsen, E. N.; Dustin, J. M.; Zuend, S. J. Catalytic asymmetric total synthesis of (+)-Yohimbine. Org. Lett. November 2008, 10 (5): 745–748. PMID 18257582. doi:10.1021/ol702781q.
- ^ Takemoto, Yoshiji; Miyabe, H. Discovery and application of asymmetric reaction by multi-functional thioureas. Bull. Chem. Soc. Jpn. July 2008, 81 (7): 785–795. doi:10.1246/bcsj.81.785
 .
.
- ^ Zuend, S. J.; Coughlin, M. P.; Lalonde, M. P.; Jacobsen, E. N. Scaleable [sic] catalytic asymmetric Strecker syntheses of unnatural alpha-amino acids. Nature. October 2009, 461 (7266): 968–970. Bibcode:2009Natur.461..968Z. PMC 2778849
 . PMID 19829379. doi:10.1038/nature08484.
. PMID 19829379. doi:10.1038/nature08484.
