克腦文蓋爾縮合反應
| 克內弗納格爾縮合反應 | |
|---|---|
| 命名根據 | 埃米爾·克內弗納格爾 |
| 反應類型 | 偶聯反應 |
| 標識 | |
| 有機化學網站對應網頁 | 克內弗納格爾縮合 |
| RSC序號 | RXNO:0000044 |
克內弗納格爾縮合反應(英語:Knoevenagel condensation)是羥醛縮合的一種改良形式,以德國化學家埃米爾·克內弗納格爾的名字命名。
含有活潑亞甲基的化合物與醛或酮在弱鹼催化下,發生失水縮合生成α,β-不飽和羰基化合物及其類似物。

Z基是吸電子基團,一般為CHO、COR、COOR、COOH、CN、NO2 等基團。兩個 Z 基可以相同,也可以不同。NO2 的吸電子能力很強,有一個就足以產生活潑氫。
常用的催化劑有哌啶、吡啶、喹啉和其他一級胺、二級胺等。常用的活潑亞甲基化合物有丙二酸二乙酯、米氏酸、乙酰乙酸乙酯、硝基甲烷和丙二酸等,但事實上任何含有能被鹼除去氫原子的 C-H 鍵化合物都能發生此反應。
克內弗納格爾縮合反應是對珀金反應的改進,活潑亞甲基化合物的存在,使得弱鹼作用下,就能產生足夠濃度的碳負離子進行親核加成。弱鹼的使用避免了醛酮的自身縮合,因此除芳香醛外,酮和脂肪醛均能進行反應,擴大了適用範圍。
克內弗納格爾縮合反應是製備α,β-不飽和化合物的常用方法之一。
歷史
[編輯]這個反應最早是由德國化學家阿圖爾·魯道夫·漢奇發現的,1885年,他用乙酰乙酸乙酯、苯甲醛和氨反應,發現生成了對稱的縮合產物 2,6-二甲基-4-苯基-1,4-二氫吡啶-3,5-二甲酸二乙酯,也生成了少量的2,4-二乙酰基-3-苯基戊二酸二乙酯,這是有關克內弗納格爾縮合反應的最早紀錄。[1][2][3]
1894年,德國化學家埃米爾·克內弗納格爾從多個方面對這一反應作了進一步研究,他發現任何一級和二級胺都可以促進反應進行;反應可以分步進行;而且丙二酸酯可以代替乙酰乙酸乙酯作為活性的亞甲基化合物。[4][5]
兩年之後,克內弗納格爾又開始了對這個反應的研究,他發現,在室溫或 0 °C 時,苯甲醛與過量乙酰乙酸乙酯在催化量的哌啶作用下,會生成雙加成物 2,4-二乙酰基-3-苯基戊二酸二乙酯。他的一個助手重複了這個實驗,在冷卻一步上消耗了更少的時間,結果發現得到的產物與之前的產物不同,這次的產物是縮合產物苄叉乙酰乙酸乙酯與上述雙加成物的混合物。進一步的研究又發現,如果使用等摩爾的苯甲醛和乙酰乙酸乙酯,將反應溫度控制在 0 °C,那麼兩者之間的反應便可以定量生成縮合產物苄叉乙酰乙酸乙酯,而基本上不產生加成物。[6] 這便是現今所看到的克內弗納格爾縮合反應的雛形,縮合產物苄叉(或烷叉)乙酰乙酸乙酯也被稱為克內弗納格爾產物。但實際上,Claisen 等早在十餘年前就已經通過其他方法得到該類型的化合物了,[7][8] 只不過克內弗納格爾所用的方法和條件更溫和一些而已。
此後的研究表明,如果用原始反應條件處理苄叉乙酰乙酸乙酯,又可得到雙加成物,從而證實了苄叉乙酰乙酸乙酯是雙加成物生成過程中的中間產物。
反應機理
[編輯]克內弗納格爾縮合反應是由鹼催化的縮合反應,類似於羥醛反應。根據所用鹼種類的不同,可以有兩種可行的機理。一種是認為醛或酮先與胺縮合為亞胺,然後再與碳負離子加成。

這個機理與克內弗納格爾最初提出的機理(下圖)有些類似。在克內弗納格爾發現這個反應之前,就已知苯甲醛可以與兩分子的哌啶縮合,生成苄叉二哌啶縮氨醛。而且苄叉二哌啶縮氨醛與乙酰乙酸乙酯在乙醇中作用時,可以高產率得到下圖中的最終產物雙加成物。[9] 因此克內弗納格爾認為,反應的機理應是胺與醛先縮合為縮氨醛,受乙酰乙酸乙酯進攻,產生 β-氨基二羰基化合物中間產物,然後消除哌啶得到 α,β-不飽和羰基化合物,並最後與另一分子乙酰乙酸乙酯進行Michael加成,得最終的雙加成產物。
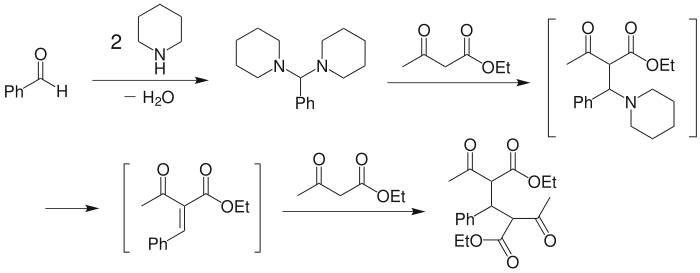
另一種機理(Hann–Lapworth 機理)則認為,首先是丙二酸二乙酯與醛在鹼作用下羥醛加成為 β-羥基二羰基化合物中間產物,然後再消除水得到縮合產物。

上述兩種機理中的中間產物 β-氨基二羰基化合物[10] 和 β-羥基二羰基化合物[11] 都已從不同的反應中分離出來。一般認為,當反應用鹼為三級胺時,Hann–Lapworth 機理佔主導地位;而當反應用鹼為一級或二級胺時,兩種機理都有可能發生。
改進法
[編輯]Doebner改進法,又稱Verley–Doebner改進法
用丙二酸或丙二酸酯作原料時,反應產生的烷叉丙二酸(酯),(經水解)可在吡啶作用下繼續脫去一個羧基,生成單羧酸。[12] 例如,丙烯醛與丙二酸在吡啶中反應,可得脫羧產物反式-2,4-戊二烯酸。[13]

應用
[編輯]1、2-甲氧基苯甲醛與二乙基硫代巴比妥酸在乙醇中發生克內弗納格爾縮合反應,以哌啶作鹼,可得電荷轉移絡合物 (3)。[14]

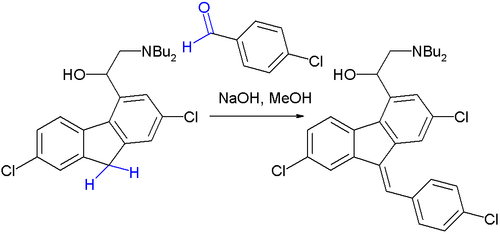
2、抗瘧疾藥物本芴醇(lumefantrine)製取中的最後一步。[15] 反應最初產物是 E/Z 異構體的 50:50 混合物,但最終會轉化為熱力學上更穩定的 Z 型異構體。
3、微波促進的環己酮、丙二腈和3-氨基-1,2,4-三唑之間發生的多組分反應。[16]

參見
[編輯]參考資料
[編輯]- ^ Dr. Arthur Hantzsch. Ueber die Synthese pyridinartiger Verbindungen aus Acetessigäther und Aldehydammoniak. Justus Liebigs Ann. Chem. 1882, 215 (1): 1–82. doi:10.1002/jlac.18822150102.
- ^ A. Hantzsch. Ueber die Condensation von Acetessigsäuremethyläther mit Aldehydammoniak. Ber. Dtsch. Chem. Ges. 1883, 16 (2): 1946–1948. doi:10.1002/cber.18830160282.
- ^ A. Hantzsch. Versuche zur Constitutionsbestimmung der synthetischen Hydropyridinderivate. Ber. Dtsch. Chem. Ges. 1885, 18 (2): 2579–2586. doi:10.1002/cber.188501802158.
- ^ E. Knoevenagel. 1,5-Diketone. Justus Liebigs Ann. Chem. 1894, 281 (1): 25–126. doi:10.1002/jlac.18942810104.
- ^ E. Knoevenagel. Ueber eine Darstellungsweise der Glutarsäure. Ber. Dtsch. Chem. Ges. 1894, 27 (2): 2345–2346. doi:10.1002/cber.189402702229.
- ^ E. Knoevenagel. Ueber eine Darstellungsweise des Benzylidenacetessigesters. Ber. Dtsch. Chem. Ges. 1896, 29 (1): 172–174. doi:10.1002/cber.18960290133.
- ^ L. Claisen. Condensationen der Aldehyde mit Acetessig- und Malonsäureäther. Ber. Dtsch. Chem. Ges. 1881, 14 (1): 345–349. doi:10.1002/cber.18810140181.
- ^ L. Claisen, L. Crismer. Ueber die Einwirkung von Benzaldehyd auf Malonsäure und Malonsäureäther. Justus Liebigs Ann. Chem.: 129–144. doi:10.1002/jlac.18832180203.
- ^ Emil Knoevenagel. Condensation von Malonsäure mit Aromatiachen Aldehyden durch Ammoniak und Amine. Ber. Dtsch. Chem. Ges. 1898, 31: 2596–2619. doi:10.1002/cber.18980310308.
- ^ Rikuhei Tanikaga, Tadashi Tamura, Yoshihito Nozaki and Aritsune Kaji. Selective synthesis of α-sulphenyl-, α-sulphinyl-, and α-sulphonyl-α,β-unsaturated carbonyl compounds by the knoevenagel reaction. J. Chem. Soc., Chem. Commun. 1984, (2): 87–88. doi:10.1039/C39840000087.
- ^ Genji Iwasaki, Seitaro Saeki and Masatomo Hamana. A Novel Nucleophilic Substitution of the Formyl Group in p-Nitrobenzaldehyde with Some Carbanions. Chem. Lett. 1986, 15 (2): 173–176. doi:10.1246/cl.1986.173.
- ^ O. Doebner. Ueber die der Sorbinsäure homologen, ungesättigten Säuren mit zwei Doppelbindungen. Ber. Dtsch. Chem. Ges. 1902, 35: 1136–1136. doi:10.1002/cber.190203501187.
- ^ Peter J. Jessup, C. Bruce Petty, Jan Roos, and Larry E. Overman (1988). "1-N-Acylamino-1,3-dienes from 2,4-pentadienoic acids by the curtius rearrangement: benzyl trans-1,3-butadiene-1-carbamate". Org. Synth.; Coll. Vol. 6: 95.
- ^ Abdullah Mohamed Asiria, Khaled Ahmed Alamrya Abraham F. Jalboutb, Suhong Zhang. 1,3-Diethyl-5-(2-methoxybenzylidene)-2-thioxodihydropyrimidine-4,6(1H,5H)-dione. Molbank. 2004: M359 [2009-09-11]. (原始內容存檔於2011-07-09).
- ^ Ulrich Beutler, Peter C. Fuenfschilling, and Andreas Steinkemper. An Improved Manufacturing Process for the Antimalaria Drug Coartem. Part II. Org. Process Res. Dev. 2007, 11 (3): 341–345. doi:10.1021/op060244p.
- ^ Anshu Dandia, Pritima Sarawgi, Kapil Arya, and Sarita Khaturia. Mild and ecofriendly tandem synthesis of 1,2,4-triazolo[4,3-a]pyrimidines in aqueous medium (PDF). Arkivoc. 2007, (06-2251BP): 83–92 [2009-09-11]. (原始內容 (PDF)存檔於2007-09-29).
