烷烴立體化學
烷烴立體化學 是有關於烷烴類的立體化學。 烷烴構象異構是烷烴立體化學的其中一個主題。
構型
[編輯]烷烴構型物是由於sp3混成軌域碳碳σ鍵的旋轉。有着這樣的化學鍵的最小烷烴類,乙烷,圍繞C-C鍵旋轉而存在着無數的構型。這些構型中的其中兩種,被認為是能量最低(交錯式構象)和能量最高(重疊式構象)的構型。這些特殊構型的存在是因為σ鍵的旋轉被阻礙,雖然有人提出與其對抗的理論—超共軛效應。 能量最低與最高的重要性,被認為可作為預測更複雜分子的穩定構型之最小能量形式。在建立不對稱誘導的觀念和預測位阻效應中立體化學的反應控制之能力,最穩定構型的決定也是佔了很重要的角色。
在紐曼式之交錯式乙烷的例子中,碳原子上的氫原子和其他碳原子上距離最近的氫原子有一個60°的扭轉角度[1],因此使得位阻效應減到最小。交錯式構象異構物較重疊式構象異構物穩定了12.5 kJ/mol,為乙烷能量的最大值。在重疊式構象異構物中的扭轉角度為最小值。



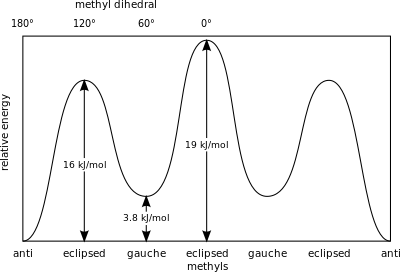
在丁烷中,兩種的交錯式構象異構物不在相等且代表不同構象:對扭構象(下圖最左側)和 間扭構象(下圖最右側)。




兩種構象都存在有扭張力,但在間扭構象中,兩個甲基團之間比凡得瓦半徑的總和還要接近。兩個甲基團之間的作用是排斥的(范德瓦耳斯力),受能量屏蔽影響。
在丁烷異構物勢能的計算中比起'對扭'異構物中有着更顯著的立體障礙,這些值由下式給出:[2]
- 間扭,異構物-3.8kJ/mol
- H和CH3 重疊-16kJ/mol
- CH3 和 CH3 重疊-19 kJ/mol.
教科書解釋位阻效應是乙烷中存在有能量最小值的重疊式構象異構物,但是,當C-C鍵長是154pm和一氫的凡得瓦半徑為120pm,乙烷上的氫原子永遠不存在其他形式。空間位阻是否代表重疊能量的最大值直至今日依然是討論的議題。另一種有別於空間位阻的解釋為超共軛效應是在自然鍵軌道的框架內進行分析。.[3][4][5] 在交錯式構象異構物中,一個C-Hσ鍵的分子軌域為其他的C-H鍵反鍵軌道提供電子密度。這個效應的能量穩定時最大化的兩個軌域有最大值的重疊,發生在交錯式構象異構物。 在重疊式構象異構物時則沒有重疊,造成最大的排斥能量。 另一方面,再分析定量分子軌域理論時顯示,內軌道2-4-電子(立體)排斥力顯性超共軛[6]價鍵理論研究也強調空間位阻效應的重要性。[7]
命名
[編輯]每標準中列出的命名烷烴化學術語總目錄做根據的的Klyne-Prelog系統指定角度(稱為扭轉或二面角)之間圍繞單鍵取代基:

- 扭轉角在0°和±90°之間稱為syn(s,順)
- 扭轉角在±90°和180°之間稱為anti(a,反)
- 扭轉角在30°和150°之間或-30°和-150°之間稱為clinal(c,錯)
- 扭轉角在0°和±30°或±150°和180°之間稱為periplanar(p,疊)
- 扭轉角在0°至±30°之間稱為synperiplanar(sp,順疊),也稱作syn-或cis-
- 扭轉角在30°到90°和-30°至-90°之間稱為synclinal(sc,順錯),也稱作gauche(鄰位交叉、間扭)或skew[8]
- 扭轉角在90°,150°或-90°和-150°之間稱為anticinal(ac,反錯)
- 扭轉角之間的±150°和180°稱為antiperiplanar(ap,反疊),也稱作anti-或trans-
扭張力扭轉一個鍵起因於排斥。
特例
[編輯]用氟取代氫在聚四氟乙烯溶液中並改變構型從鋸齒型改變為螺旋型,利用1,3位置的的氟透過靜電斥力取代氫。利用X射線晶體學和核磁共振波譜法在溶液中的圓二色性證明結晶狀態下的螺旋結構。
參見
[編輯]引用
[編輯]- ^ Gold Book Link (頁面存檔備份,存於互聯網檔案館)
- ^ Organic Chemistry 6e, McMurray, J.E., Brooks Cole (2003)
- ^ Hyperconjugation not steric repulsion leads to the staggered structure of ethane. Pophristic, V. & Goodman, L. 自然 (期刊) 411, 565–568 (2001)Abstract (頁面存檔備份,存於互聯網檔案館)
- ^ Chemistry: A new twist on molecular shape Frank Weinhold 自然 (期刊) 411, 539-541 (31 May 2001)
- ^ Rebuttal to the Bickelhaupt-Baerends case for steric repulsion causing the staggered conformation of ethane. Weinhold, F. Angew. Chem. Int. Ed. 42, 4188-4194 (2003)
- ^ The case for steric repulsion causing the staggered conformation of ethane. Bickelhaupt, F.M. & Baerends, E.J. Angew. Chem. Int. Ed. 42, 4183-4188 (2003)
- ^ The magnitude of hyperconjugation in ethane: A perspective from ab initio valence bond theory. Mo, Y.R. et al. Angew. Chem. Int. Ed. 43, 1986-1990 (2004)
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "gauche"。doi:10.1351/goldbook.G02593
