同分異構
此條目沒有列出任何參考或來源。 (2023年3月10日) |

同分異構體(英語:Isomer)是擁有相同分子式,但結構式卻不相同的多種分子。其彼此間的化學性質並不相同,除非它們擁有相同的官能基(functional groups)。化學中常見的兩種主要的種類為結構異構(structural isomerism或constitutional isomerism)以及立體異構(stereoisomerism)。
歷史
[編輯]同分異構現象第一次被注意到是在1827年,當弗里德里希·維勒製備異氰酸的時候,他注意到儘管元素組成與尤斯圖斯·馮·李比希在前一年製備出來的雷酸完全相同,但是它們的性質卻極為不同。這個發現挑戰了當時的主流化學界的理解,當時主流思想認為僅當元素組不同的時候,化合物才會不同。隨着更多此類現象被發現,比如維勒在1828年發現尿素與氰酸銨有着相同的原子組成卻有着不同的性質,永斯·貝采利烏斯便引進「同分異構」來描述這種現象。
例子
[編輯]丙醇是「同分異構體」的一個簡單的例子:它的分子式是C3H8O(或C3H7OH)它的兩個同分異構體是1-丙醇(I)和2-丙醇(II)
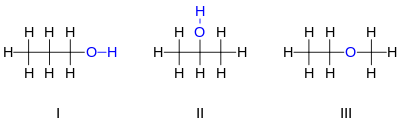
可以注意到兩個分子中的氧原子的位置是不同的:在第一個同分異構體中,它是連接在末端碳原子上,而在第二個分子中是連接在中間碳原子上。同分異構體的個數隨着原子的個數增長而急劇增加。比如丁醇(C4H10O)就含有4個不同的同分異構體。
在上述例子中,兩個同分異構體所有的化學鍵均為共價鍵,沒有任何一個類型的鍵在其中一個分子中出現而不在另外一個分子中出現。同樣,鍵的數量也是一樣的。根據兩個分子的結構我們可以推測它們的化學穩定性很可能是相同或相似的。
然而,另外一個C3H7OH的同分異構體-甲基乙基醚(III),卻有着截然不同的性質。和上面兩個例子不同的是,氧原子並不是連接着一個碳原子和一個氫原子,而是和兩個碳原子相連。因為它沒有羥基,上面這個化合物並不是一個醇而是一個醚,因此它的化學性質和其他的醚更加相近。
另外一個有着不同化學性質的同分異構體的例子是黃嘌呤。巧克力中的可可鹼中如果兩個甲基中的一個移動到雙環上的另外一個位置,這個同分異構體就是茶鹼了。

分類
[編輯]結構異構
[編輯]在結構異構中,原子或官能基以不同的形式互相連接。
碳鏈異構
[編輯]官能基不發生改變,僅僅是碳鏈發生改變。
例:C4H10(丁烷)
位置異構
[編輯]例:C3H7OH
官能基異構
[編輯]相同的原子組成的官能基不同
例:C2H6O
立體異構
[編輯]在立體異構中,鍵的結構是相同的,但是原子和官能基的空間位置關係卻是不同的。
光學異構(手性異構)
[編輯]在光學異構物中,不同的兩個異構物是呈鏡面對稱的。如上圖上面兩個互為鏡像的分子。
非光學異構
[編輯]在非光學異構體中,兩個異構分子不呈鏡面對稱。如上圖中上下兩個分子。
構象異構
[編輯]在構象異構中,同分異構體之間可以通過化學鍵的旋轉而互相變化。但應該注意到,儘管構象異構物可以被認為是一種非光學異構體,但是從整體來看,它們並不是非光學異構體,因為鍵的旋轉可以使它們形成它們的鏡像。
順反異構
[編輯]順反異構物之間是不能通過化學鍵的旋轉而互相轉化,這是由於例如碳碳雙鍵等不可旋轉的鍵造成的。
其他非對應異構
[編輯]等規(isotatic),間規(syndiotactic),無規(atactic)排佈
意義
[編輯]在食品化學,藥物化學和生物化學當中,順反異構物是經常要被考慮到的。而光學異構體在近幾十年來成為了藥物化學和生物化學關注的焦點,因為在生物有機體當中,我們知道的大部分此類異構物間的轉化是有意義的。醫藥工業和大學裏面的研究員們已經把色析法作為一種有效的分離兩個同分異構體的辦法。然而,這種方法在工業化的環境下是不適用的,因為它們十分昂貴,因此僅當另一個同分異構體有潛在危害的時候才使用。
與構型異構物之間有着不同的化學性質不一樣,幾何異構物之間通常有着相同的化學性質。然而酶能夠有效地區分出一個化合物的幾個幾何異構物,生物有機體也常常傾向於某一個異構物。一些異構物之間偏振光能力也不同。
除了上述的幾種同分異構體,還存在拓撲異構物和同位素異構物。幾個拓撲異構物的例子是一些雙環化合物和DNA,拓撲異構酶能夠使DNA打結改變它的拓撲結構。同位素異構物有着相同數量的同位素取代,但是它們有着不同的位置。在核物理中,核異構物則是原子核的激發態。