单域抗体

其中用橙色标识出互补决定区的第三个转角(CDR3)。
单域抗体(Single-domain antibody, sdAb)是指包含了抗体中单个可变域的片段,开发这一技术的Ablynx公司称为纳米抗体(Nanobody)[1]。和完整的抗体一样,它可以选择性的和特定抗原结合。单域抗体的分子量大约为12-15 kDa,远小于完整抗体的150-160 kDa,这一差异主要源于单域抗体缺少完整抗体中的轻链和可结晶片段(Fc区)。即使与仅含一条轻链和半条重链的抗原结合片段(约50 kDa)相比,单域抗体也显得更加小巧[2]。
第一个单域抗体是从骆驼的重链抗体中人造工程制作出来的,称为“VHH区段”。软骨鱼也有重链抗体(IgNAR,免疫球蛋白新抗原感受器Immunoglobulin new antigen receptor的缩写),从该类抗体也可以制作出称为“VNAR区段”的单域抗体。另一种制作方法是将普通的、含有两种可变区的人或鼠IgG抗体分解成单域抗体。尽管大多数对单域抗体的研究都是基于重链可变区的,但轻链所发展出来的纳体也展现出可以与目标抗原的抗原表位特异结合的能力[3]。
单域抗体正被研究用于多种制药应用场景,并且在治疗急性冠脉综合征、癌症和阿兹海默病等上面具有前景[4][5]。
性质
[编辑]单域抗体通常由约110个氨基酸组成,包含了抗体(或者说G型免疫球蛋白)中的一个重链可变域(VH)。它们对抗原的特异性程度与完整的抗体相似,但热稳定性好,在清洁剂和高浓度尿素环境下稳定。从骆驼和鱼的抗体中获得的单域抗体脂溶性较差,而更易溶于水。这得益于其互补决定区的第三个转角,该延展出来的转角(图中橙色部分)遮挡了本应和轻链结合的亲脂点位[6][7]。在1999年的研究中发现,每6个单域抗体中就有两个能够在90°C(194°F)的环境中保持活性,比普通抗体表现要更好[8]。在胃酸与蛋白酶中的稳定性和氨基酸序列有关,某些类型已显示出口服后在肠道里能保持活性[9][10],但其吸收率之低阻碍了全身活性单域抗体药物的开发。
相对于完整抗体,单域抗体的分子质量更低,这使其更容易渗透到组织中。同时,由于更容易通过肾脏清除,因此其药代动力学半衰期也更短[2]。此外,由于它们没有可结晶区,因此无法通过补体系统引发细胞毒性。从骆驼和鱼身上发展出来的单域抗体可以与那些完整抗体无法接触到隐藏抗原相结合,比如说酶的活性点位。这一属性被发现源自于他们补体决定区3(CD3)延长的转角,这一特点使之可以渗透至上述点位[7][11]。
产品
[编辑]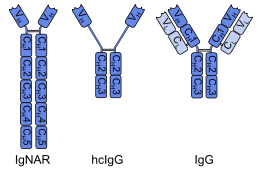
来自重链抗体
[编辑]单域抗体可以通过用特定抗原激活单峰骆驼、双峰骆驼、羊驼、大羊驼或者鲨鱼的免疫系统,然后分离产生重链抗体的mRNA来取得。通过逆转录和聚合酶链式反应,可以获得一个包含了数百万个单域抗体克隆的基因库。通过诸如噬菌体展示和核糖体展示之类的筛查技术,可以识别出与抗原相结合的克隆[12]。
另一种方式是从未经免疫反应刺激的动物身上获取基因库,这种原始基因库通常只包含与期望抗原亲和度低的抗体基因,因此需要施以随机诱变这一额外步骤来提高亲和力[13]。
当识别出最有潜力的克隆后,他们的DNA序列会进行一些调整,例如使它们能够稳定于酶。而另一个目标则是人源化,以避免人机体中的免疫反应对抗这种抗体。由于骆驼的VHH片段和人类的VH同源,因此不是问题[13]。最后一步则是将调整过的单域抗体基因转录至大肠杆菌或酿酒酵母等合适的生物体中,以便进行生产。
来自普通抗体
[编辑]此外,单域抗体还可以通过常见的小鼠或人类丙种免疫球蛋白制作获得[14],后者拥有四条链。其制作过程与前面的方法类似,包括了从原始的或者免疫激活供体重获取基因库,以及通过展示筛查技术来识别具备特异性的抗体克隆。该方法的一个问题是,普通的IgG互补结合区拥有重链和轻链两个域,由于其脂溶性导致容易形成二聚体。单体化过程通常通过用亲水氨基酸替换疏水氨基酸来达成。但是这一过程通常会导致抗体丧失针对原有抗原的亲和力[15]。如果亲和力在经过这一步骤之后仍然得以保留,即可如前一种方法,通过大肠杆菌、酿酒酵母等生物体来生产。
潜在应用场景
[编辑]口服的单域抗体已在仔猪上治疗大肠杆菌引起的腹泻的测试上取得了成功[10],其它的消化道疾病如炎症性肠病和大肠癌,也可能是其潜在应用场景[16]。而针对引起头屑的马拉色菌,也已经制作出与其某一表面蛋白结合的,能在洗涤剂中稳定存在的单域抗体,被用于抗头屑洗发香波[6]。
而另一种已在临床试验阶段的ALX-0081单域抗体能和血管性血友病因子特异结合,用于避免因血栓形成而导致的急性冠脉综合征[17]。2009年9月,在高风险冠狀動脈再成形術上展开了2期临床试验[18]。
Ablynx公司预期单域抗体可以通过血脑屏障,并且和完整的抗体相比更容易渗透到大型肿瘤当中,因此有可能可以开发出治疗脑肿瘤的药物[16]。
参考文献
[编辑]- ^ Gibbs, W. Wayt. Nanobodies. Scientific American Magazine. August 2005 [2012-04-22]. (原始内容存档于2007-10-10).
- ^ 2.0 2.1 Harmsen MM, De Haard HJ. Properties, production, and applications of camelid single-domain antibody fragments. Appl. Microbiol. Biotechnol. November 2007, 77 (1): 13–22. PMC 2039825
 . PMID 17704915. doi:10.1007/s00253-007-1142-2.
. PMID 17704915. doi:10.1007/s00253-007-1142-2.
- ^ Möller, A.; Pion, E; Narayan, V; Ball, KL. Intracellular activation of interferon regulatory factor-1 by nanobodies to the multi-functional (Mf1) domain. The Journal of Biological Chemistry (J Biol Chem). September 2010, 285 (49): 38348–38361 [2012-04-22]. PMC 2992268
 . PMID 20817723. doi:10.1074/jbc.M110.149476. (原始内容存档于2017-03-12).
. PMID 20817723. doi:10.1074/jbc.M110.149476. (原始内容存档于2017-03-12).
- ^ Nanobodies herald a new era in cancer therapy. The Medical News. 12 May 2004 [2012-04-22]. (原始内容存档于2021-02-16).
- ^ Pipeline. Ablynx. [20 January 2010]. (原始内容存档于2010年1月4日).
- ^ 6.0 6.1 PMID 15640220
- ^ 7.0 7.1 Robyn L. Stanfield, Helen Dooley, Martin F. Flajnik, Ian A. Wilson. Crystal Structure of a Shark Single-Domain Antibody V Region in Complex with Lysozyme. Science. 2004-09-17, 305 (5691): 1770–1773 [2018-04-02]. ISSN 0036-8075. doi:10.1126/science.1101148. (原始内容存档于2021-06-18) (英语).
- ^ PMID 10209277
- ^ PMID 16221532
- ^ 10.0 10.1 PMID 16450109
- ^ PMID 8784355
- ^ PMID 9323027
- ^ 13.0 13.1 PMID 18691671
- ^ PMID 14573361
- ^ PMID 12454662
- ^ 16.0 16.1 Nanobodies. Nanobody.org. 2006 [2021-08-15]. (原始内容存档于2021-02-16).
- ^ Ablynx Announces Interim Results of First Nanobody Phase I Study of,ALX-0081 (ANTI-VWF). Bio-Medicine.org. 2 July 2007 [2012-04-22]. (原始内容存档于2021-02-16).
- ^ Clinical trial number NCT01020383 for "Comparative Study of ALX-0081 Versus GPIIb/IIIa Inhibitor in High Risk Percutaneous Coronary Intervention (PCI) Patients" at ClinicalTrials.gov

