單域抗體

其中用橙色標識出互補決定區的第三個轉角(CDR3)。
單域抗體(Single-domain antibody, sdAb)是指包含了抗體中單個可變域的片段,開發這一技術的Ablynx公司稱為納米抗體(Nanobody)[1]。和完整的抗體一樣,它可以選擇性的和特定抗原結合。單域抗體的分子量大約為12-15 kDa,遠小於完整抗體的150-160 kDa,這一差異主要源於單域抗體缺少完整抗體中的輕鏈和可結晶片段(Fc區)。即使與僅含一條輕鏈和半條重鏈的抗原結合片段(約50 kDa)相比,單域抗體也顯得更加小巧[2]。
第一個單域抗體是從駱駝的重鏈抗體中人造工程製作出來的,稱為「VHH區段」。軟骨魚也有重鏈抗體(IgNAR,免疫球蛋白新抗原感受器Immunoglobulin new antigen receptor的縮寫),從該類抗體也可以製作出稱為「VNAR區段」的單域抗體。另一種製作方法是將普通的、含有兩種可變區的人或鼠IgG抗體分解成單域抗體。儘管大多數對單域抗體的研究都是基於重鏈可變區的,但輕鏈所發展出來的納體也展現出可以與目標抗原的抗原表位特異結合的能力[3]。
單域抗體正被研究用於多種製藥應用場景,並且在治療急性冠脈綜合徵、癌症和阿茲海默病等上面具有前景[4][5]。
性質
[編輯]單域抗體通常由約110個氨基酸組成,包含了抗體(或者說G型免疫球蛋白)中的一個重鏈可變域(VH)。它們對抗原的特異性程度與完整的抗體相似,但熱穩定性好,在清潔劑和高濃度尿素環境下穩定。從駱駝和魚的抗體中獲得的單域抗體脂溶性較差,而更易溶於水。這得益於其互補決定區的第三個轉角,該延展出來的轉角(圖中橙色部分)遮擋了本應和輕鏈結合的親脂點位[6][7]。在1999年的研究中發現,每6個單域抗體中就有兩個能夠在90°C(194°F)的環境中保持活性,比普通抗體表現要更好[8]。在胃酸與蛋白酶中的穩定性和氨基酸序列有關,某些類型已顯示出口服後在腸道里能保持活性[9][10],但其吸收率之低阻礙了全身活性單域抗體藥物的開發。
相對於完整抗體,單域抗體的分子質量更低,這使其更容易滲透到組織中。同時,由於更容易通過腎臟清除,因此其藥代動力學半衰期也更短[2]。此外,由於它們沒有可結晶區,因此無法通過補體系統引發細胞毒性。從駱駝和魚身上發展出來的單域抗體可以與那些完整抗體無法接觸到隱藏抗原相結合,比如說酶的活性點位。這一屬性被發現源自於他們補體決定區3(CD3)延長的轉角,這一特點使之可以滲透至上述點位[7][11]。
產品
[編輯]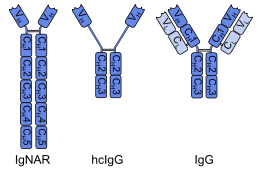
來自重鏈抗體
[編輯]單域抗體可以通過用特定抗原激活單峰駱駝、雙峰駱駝、羊駝、大羊駝或者鯊魚的免疫系統,然後分離產生重鏈抗體的mRNA來取得。通過逆轉錄和聚合酶鏈式反應,可以獲得一個包含了數百萬個單域抗體克隆的基因庫。通過諸如噬菌體展示和核糖體展示之類的篩查技術,可以識別出與抗原相結合的克隆[12]。
另一種方式是從未經免疫反應刺激的動物身上獲取基因庫,這種原始基因庫通常只包含與期望抗原親和度低的抗體基因,因此需要施以隨機誘變這一額外步驟來提高親和力[13]。
當識別出最有潛力的克隆後,他們的DNA序列會進行一些調整,例如使它們能夠穩定於酶。而另一個目標則是人源化,以避免人機體中的免疫反應對抗這種抗體。由於駱駝的VHH片段和人類的VH同源,因此不是問題[13]。最後一步則是將調整過的單域抗體基因轉錄至大腸桿菌或釀酒酵母等合適的生物體中,以便進行生產。
來自普通抗體
[編輯]此外,單域抗體還可以通過常見的小鼠或人類丙種免疫球蛋白製作獲得[14],後者擁有四條鏈。其製作過程與前面的方法類似,包括了從原始的或者免疫激活供體重獲取基因庫,以及通過展示篩查技術來識別具備特異性的抗體克隆。該方法的一個問題是,普通的IgG互補結合區擁有重鏈和輕鏈兩個域,由於其脂溶性導致容易形成二聚體。單體化過程通常通過用親水氨基酸替換疏水氨基酸來達成。但是這一過程通常會導致抗體喪失針對原有抗原的親和力[15]。如果親和力在經過這一步驟之後仍然得以保留,即可如前一種方法,通過大腸桿菌、釀酒酵母等生物體來生產。
潛在應用場景
[編輯]口服的單域抗體已在仔豬上治療大腸桿菌引起的腹瀉的測試上取得了成功[10],其它的消化道疾病如炎症性腸病和大腸癌,也可能是其潛在應用場景[16]。而針對引起頭屑的馬拉色菌,也已經製作出與其某一表面蛋白結合的,能在洗滌劑中穩定存在的單域抗體,被用於抗頭屑洗髮香波[6]。
而另一種已在臨床試驗階段的ALX-0081單域抗體能和血管性血友病因子特異結合,用於避免因血栓形成而導致的急性冠脈綜合徵[17]。2009年9月,在高風險冠狀動脈再成形術上展開了2期臨床試驗[18]。
Ablynx公司預期單域抗體可以通過血腦屏障,並且和完整的抗體相比更容易滲透到大型腫瘤當中,因此有可能可以開發出治療腦腫瘤的藥物[16]。
參考文獻
[編輯]- ^ Gibbs, W. Wayt. Nanobodies. Scientific American Magazine. August 2005 [2012-04-22]. (原始內容存檔於2007-10-10).
- ^ 2.0 2.1 Harmsen MM, De Haard HJ. Properties, production, and applications of camelid single-domain antibody fragments. Appl. Microbiol. Biotechnol. November 2007, 77 (1): 13–22. PMC 2039825
 . PMID 17704915. doi:10.1007/s00253-007-1142-2.
. PMID 17704915. doi:10.1007/s00253-007-1142-2.
- ^ Möller, A.; Pion, E; Narayan, V; Ball, KL. Intracellular activation of interferon regulatory factor-1 by nanobodies to the multi-functional (Mf1) domain. The Journal of Biological Chemistry (J Biol Chem). September 2010, 285 (49): 38348–38361 [2012-04-22]. PMC 2992268
 . PMID 20817723. doi:10.1074/jbc.M110.149476. (原始內容存檔於2017-03-12).
. PMID 20817723. doi:10.1074/jbc.M110.149476. (原始內容存檔於2017-03-12).
- ^ Nanobodies herald a new era in cancer therapy. The Medical News. 12 May 2004 [2012-04-22]. (原始內容存檔於2021-02-16).
- ^ Pipeline. Ablynx. [20 January 2010]. (原始內容存檔於2010年1月4日).
- ^ 6.0 6.1 PMID 15640220
- ^ 7.0 7.1 Robyn L. Stanfield, Helen Dooley, Martin F. Flajnik, Ian A. Wilson. Crystal Structure of a Shark Single-Domain Antibody V Region in Complex with Lysozyme. Science. 2004-09-17, 305 (5691): 1770–1773 [2018-04-02]. ISSN 0036-8075. doi:10.1126/science.1101148. (原始內容存檔於2021-06-18) (英語).
- ^ PMID 10209277
- ^ PMID 16221532
- ^ 10.0 10.1 PMID 16450109
- ^ PMID 8784355
- ^ PMID 9323027
- ^ 13.0 13.1 PMID 18691671
- ^ PMID 14573361
- ^ PMID 12454662
- ^ 16.0 16.1 Nanobodies. Nanobody.org. 2006 [2021-08-15]. (原始內容存檔於2021-02-16).
- ^ Ablynx Announces Interim Results of First Nanobody Phase I Study of,ALX-0081 (ANTI-VWF). Bio-Medicine.org. 2 July 2007 [2012-04-22]. (原始內容存檔於2021-02-16).
- ^ Clinical trial number NCT01020383 for "Comparative Study of ALX-0081 Versus GPIIb/IIIa Inhibitor in High Risk Percutaneous Coronary Intervention (PCI) Patients" at ClinicalTrials.gov

