电压门控离子通道
 离子用红色圆圈表示。梯度由膜两侧的离子浓度不同表示。离子通道的开放构形允许离子跨膜运输,而封闭构型则不允许。 | |
| 鉴定 | |
|---|---|
| 标志 | VIC |
| Pfam宗系 | CL0030(旧版) |
| TCDB | 1.A.1 |
| OPM家族 | 8 |
| OPM蛋白 | 2a79 |
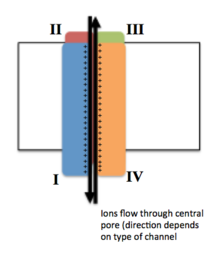
电压门控离子通道(英语:Voltage-gated ion channels)是一类跨膜蛋白,在附近的膜电位变化时来可激活形成离子通道。膜电位改变可改变该通道蛋白的构象,来调节其打开和关闭。离子通常情况下不可渗透细胞膜,因此它们必须通过跨膜的蛋白通道来穿越细胞膜。通道的打开和关闭是通过改变细胞膜两侧之间的离子浓度以及电荷梯度来触发的[1]。
电压门控离子通道在神经细胞和肌肉组织等兴奋性细胞中起著至关重要的作用,可以响应触发电压变化而快速而协调地进行去极化。沿著轴突和突触处建立的电压闸门离子通道定向传播电信号。电压门控离子通道通常是离子特异性的,现在已经发现了钠离子(Na+)、钾离子(K+)、钙离子(Ca2+)和氯离子(Cl-)的通道[2]。
结构
[编辑]
电压门控离子通道的跨膜区通常由几个同源结构域组成,这结构域在细胞膜上排列,让中间形成一个可开闭的孔道,可以使离子在电化学梯度的作用下跨膜流动。这些通道通常是离子特异性的,每种通道只能通过特定离子,尽管大小相近、带电荷数相同的离子有时也会穿过它们[3]。 Na+、K+和Ca2+的通道都由四个同源结构域组成,这四个同源结构域以平面正方形排列,中间形成一个可让离子流动的孔道。其中大部分的Na+和Ca2+离子通道,四个同源结构域位于一条肽链上,而K+离子通道则是位于四条肽链上形成四聚体,如图[4]。跨膜区总共分为S1-S6六个由α螺旋组成的节段,其中第五个和第六个跨膜节段(S5和S6)形成了让离子通过的中心孔,其变构决定了离子通道的开关。而S1-S4节段为电压感应区,其中的S4节段的氨基酸残基带正电,感应跨膜电压的变化来变构调节S5和S6节段构象,从而使离子通道打开或关闭[3]。上述跨膜蛋白可称为离子通道的α亚基,此外完整的离子通道还具有β调节亚基,具有氧化还原酶活性,定位于细胞膜内侧而非跨膜,在内质网与α亚基组装在一起[5]。
机制
[编辑]离子通道中最早完成X射线晶体衍射图谱的是钾离子通道,当细胞膜内外存在电势差时,电场会引起钾通道的构象变化。这种构象变化改变了通道蛋白的形状,使得四个同源结构域中的空腔通道打开,允许K+通过膜流入或流出。K+向着浓度低的移动,产生足以使细胞膜去极化的电流。
电压门控钠离子通道和电压门控钙离子通道通常由带有四个同源结构域的单个肽链形成。每个同源结构域带有6个跨膜α-螺旋,其中的S4节段涉及电压的感应[6]。在钾通道和钠通道中,感应电压的S4节段富含赖氨酸、精氨酸残基带有许多正电荷,因此细胞外的高正电会排斥该α-螺旋,从而使通道保持在闭合状态[3]。
在静息电位下,每个S4螺旋的一半与细胞胞浆接触。去极化后,外界电场减弱,S4节段上的带正电残基向膜的外表面移动[4][7],触发构象变化,从而打开通道[3]。

电压感应区的S3b节段S4节段在不同物种中高度保守,且在多个物种的电压敏感磷酸酶的电压感应区中也存在类似的结构[8]。沟过基因工程将一种火山古菌的钾离子通道基因片段转入大鼠大脑中,发现转入的钾离子通道能正常工作[9][10]。
虽然电压门控离子通道通常是通过膜的去极化来激活的,但有些通道,如内向整流钾离子通道,是通过超极化来激活的。
在电压门控离子通道打开几毫秒后,离子通道会进入失活状态[11]。其中钾通道至少存在两种失活类型,即快速失活型(N型)和慢速失活型(C型)[12]。N型失活是一种“球与链”失活,在失活过程中,胞内区肽链会折叠起来,使得N-末端的球会阻碍离子通过通道的流动[13]。快速失活与S4节段膜内运动直接相关[14]。
各种类型
[编辑]钠离子(Na+)通道
[编辑]钠离子通道在许多不同的细胞类型中具有相似的功能特性。在人类基因组中有10个钠离子通道基因,这些基因在进化中高度保守[14]。
钙离子(Ca2+)通道
[编辑]人类基因组中共有16个不同的电压门控钙离子通道基因,钙离子通道在不同细胞类型中的功能不同。在一些神经元中Ca2+产生动作电位的方式和Na+类似。钙通道也在神经末梢的化学突触的神经递质释放中起作用。 在大多数细胞中,Ca2+通道通过调控细胞内Ca2+的浓度来调节各种各样的生化过程<[15]。
钾离子(K+)通道
[编辑]电压门控钾离子通道是电压门控通道中最大和最多样化的一类,在人类基因组中有超过100个基因。这些类型的通道在门控特性上有很大的不同;有些失活极慢,有些失活极快。这种激活时间的差异会影响动作电位的持续时间和频率,这对轴突上的电信号传导以及突触传递有着重要的影响。钾通道与其他通道在结构上的不同之处在于它们包含四个独立的多肽亚基,而其他通道虽然也包含四个同源结构域,但只有一个多肽链[7]。
氯离子(Cl−)通道
[编辑]氯离子通道存在于所有类型的神经元中,主要负责控制细胞的兴奋性,有助于维持细胞静息电位和调节细胞体积大小[2]。
质子(H+)通道
[编辑]电压门控质子通道是氢正离子的跨膜通道,并以pH依赖的方式被去极化激活。它们的作用是除去细胞中的酸[16][17][18]。
系统进化
[编辑]2004年的一项系统发育研究发现细菌的电压门控钠离子通道构成了一个蛋白质超家族[19]。之后多项研究将许多其它离子通道和离子泵与电压门控离子通道整合成一个系统发育树,包括内向整流钾离子通道、兰尼碱肌醇1,4,5-三磷酸受体钙通道、瞬时受体电位钙通道家族、多囊蛋白阳离子通道家族、谷氨酸门控离子通道家族、钙依赖性的氯离子通道、单价阳离子:质子逆向转运蛋白-1基因家族和钾转运蛋白家族等[20]。
参考资料
[编辑]- ^ Catterall WA. From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels. Neuron. April 2000, 26 (1): 13–25. PMID 10798388. doi:10.1016/S0896-6273(00)81133-2 (英语).
- ^ 2.0 2.1 Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM. Voltage-Gated Ion Channels. Neuroscience 2nd. Sunderland, Mass: Sinauer Associates. 2001 [2020-10-14]. ISBN 978-0-87893-742-4. (原始内容存档于2018-06-05).
- ^ 3.0 3.1 3.2 3.3 Bezanilla F. Voltage-gated ion channels. IEEE Transactions on NanoBioscience. March 2005, 4 (1): 34–48. PMID 15816170. doi:10.1109/tnb.2004.842463.
- ^ 4.0 4.1 Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J. Section 21.3, Molecular Properties of Voltage-Gated Ion Channels. Molecular Cell Biology
 4th. New York: Scientific American Books. 2000. ISBN 978-0-7167-3136-8.
4th. New York: Scientific American Books. 2000. ISBN 978-0-7167-3136-8.
- ^ Gulbis JM, Mann S, MacKinnon R. Structure of a voltage-dependent K+ channel beta subunit. Cell. June 1999, 97 (7): 943–52. PMID 10399921. doi:10.1016/s0092-8674(00)80805-3.
- ^ Catterall WA. Ion channel voltage sensors: structure, function, and pathophysiology. Neuron. 2010, 67 (6): 915–28. PMC 2950829
 . PMID 20869590. doi:10.1016/j.neuron.2010.08.021.
. PMID 20869590. doi:10.1016/j.neuron.2010.08.021.
- ^ 7.0 7.1 Sands Z, Grottesi A, Sansom MS. Voltage-gated ion channels. Current Biology. 2005, 15 (2): R44–7. PMID 15668152. doi:10.1016/j.cub.2004.12.050
 .
.
- ^ Murata Y, Iwasaki H, Sasaki M, Inaba K, Okamura Y. Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor. Nature. June 2005, 435 (7046): 1239–43. Bibcode:2005Natur.435.1239M. PMID 15902207. doi:10.1038/nature03650.
- ^ Alabi AA, Bahamonde MI, Jung HJ, Kim JI, Swartz KJ. Portability of paddle motif function and pharmacology in voltage sensors. Nature. November 2007, 450 (7168): 370–5. Bibcode:2007Natur.450..370A. PMC 2709416
 . PMID 18004375. doi:10.1038/nature06266.
. PMID 18004375. doi:10.1038/nature06266.
- ^ Long SB, Tao X, Campbell EB, MacKinnon R. Atomic structure of a voltage-dependent K+ channel in a lipid membrane-like environment. Nature. November 2007, 450 (7168): 376–82. Bibcode:2007Natur.450..376L. PMID 18004376. doi:10.1038/nature06265.
- ^ Armstrong CM. Sodium channels and gating currents. Physiological Reviews. July 1981, 61 (3): 644–83. PMID 6265962. doi:10.1152/physrev.1981.61.3.644.
- ^ 离子通道学. Wu han: Hu bei ke xue ji zhu chu ban she. ISBN 9787535238337.
- ^ Vassilev P, Scheuer T, Catterall WA. Inhibition of inactivation of single sodium channels by a site-directed antibody. Proceedings of the National Academy of Sciences of the United States of America. October 1989, 86 (20): 8147–51. Bibcode:1989PNAS...86.8147V. PMC 298232
 . PMID 2554301. doi:10.1073/pnas.86.20.8147.
. PMID 2554301. doi:10.1073/pnas.86.20.8147.
- ^ 14.0 14.1 Bénitah JP, Chen Z, Balser JR, Tomaselli GF, Marbán E. Molecular dynamics of the sodium channel pore vary with gating: interactions between P-segment motions and inactivation. The Journal of Neuroscience. March 1999, 19 (5): 1577–85. PMC 6782169
 . PMID 10024345. doi:10.1523/JNEUROSCI.19-05-01577.1999.
. PMID 10024345. doi:10.1523/JNEUROSCI.19-05-01577.1999.
- ^ Jiang Y, Lee A, Chen J, Cadene M, Chait BT, MacKinnon R. Crystal structure and mechanism of a calcium-gated potassium channel. Nature. May 2002, 417 (6888): 515–22. Bibcode:2002Natur.417..515J. PMID 12037559. doi:10.1038/417515a.
- ^ Cherny, V.V.; Markin, V.S.; DeCoursey, T.E., The voltage-activated hydrogen ion conductance in rat alveolar epithelial cells is determined by the pH gradient, Journal of General Physiology 105 (6), 1995, 105 (6): 861–896June 1995, PMC 2216954
 , PMID 7561747, doi:10.1085/jgp.105.6.861
, PMID 7561747, doi:10.1085/jgp.105.6.861
- ^ DeCoursey, T.E., Voltage-gated proton channels and other proton transfer pathways, Physiological Reviews 83 (2), 2003, 83 (2): 475–5792003, OCLC 205658168, PMID 12663866, doi:10.1152/physrev.00028.2002
- ^ Ramsey, I. Scott; Mokrab, Younes; Carvacho, Ingrid; Sands, Zara A.; Sansom, Mark S.P.; Clapham, David E. An aqueous H+ permeation pathway in the voltage-gated proton channel Hv1. Nature Structural & Molecular Biology. 2010, 17 (7): 869–875. PMC 4035905
 . PMID 20543828. doi:10.1038/nsmb.1826.
. PMID 20543828. doi:10.1038/nsmb.1826.
- ^ Koishi R, Xu H, Ren D, Navarro B, Spiller BW, Shi Q, Clapham DE. A superfamily of voltage-gated sodium channels in bacteria. The Journal of Biological Chemistry. March 2004, 279 (10): 9532–8. PMID 14665618. doi:10.1074/jbc.M313100200
 .
.
- ^ Chang, Abraham B.; Lin, Ron; Studley, W. Keith; Tran, Can V.; Saier, Milton H., Jr. Phylogeny as a guide to structure and function of membrane transport proteins. Mol Membr Biol. 2004, 21 (3): 171–181. PMID 15204625. doi:10.1080/09687680410001720830.
