砷酸
| 砷酸 | |
|---|---|
| |

| |
| IUPAC名 Arsenic acid, arsoric acid | |
| 识别 | |
| CAS号 | 7778-39-4 |
| ChemSpider | 229 |
| SMILES |
|
| InChI |
|
| InChIKey | DJHGAFSJWGLOIV-UHFFFAOYAY |
| ChEBI | 18231 |
| RTECS | CG0700000 |
| KEGG | C01478 |
| 性质 | |
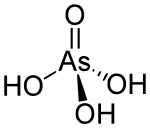
| 化学式 | H3AsO4 |
| 摩尔质量 | 141.94 g/mol g·mol⁻¹ |
| 外观 | 白色半透明潮解晶体 |
| 密度 | 2.5 g/cm3 |
| 熔点 | 35.5 °C(309 K) |
| 沸点 | ≥ 100 °C 分解 |
| 溶解性(水) | 16.7 g/100 mL |
| 溶解性 | 溶于乙醇 |
| pKa | 2.19, 6.94, 11.5 |
| 结构 | |
| 分子构型 | 四面体 |
| 危险性 | |
| 警示术语 | R:R23/25, R45, R50/53 |
| 安全术语 | S:S53, S45, S60, S61 |
| 欧盟分类 | |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | 磷酸 |
| 其他阳离子 | 砷酸钠 |
| 相关化学品 | 亚砷酸 五氧化二砷 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
砷酸为砷(V)的含氧酸,分子式H3AsO4。三元中强酸,酸性及其他性质均类似磷酸。
制取
[编辑]由五氧化二砷溶于水而得。
反应也可向左进行,如加入五氧化二磷作吸水剂时,又可从砷酸产生五氧化二砷。
砷酸也可由砷或三氧化二砷被浓硝酸氧化而得。该反应会生成副产物三氧化二氮。反应后于29.5°C以下浓缩,可析出砷酸半水合物细小板状结晶。于29.5℃以上,则析出三砷酸(H5As3O10)。[1][2]
反应结束后,若将所得液体冷却,可得到以无色结晶形式析出的砷酸的半水合物H3AsO4·½H2O。如果进一步降低温度的话,还可以获得砷酸的二水合物H3AsO4·2H2O[2]。
砷酸二水合物(H3AsO4 · 2H2O)只可通过在−30°C下结晶数天得到。[3]
五氧化二砷可缓慢与水反应生成砷酸。元砷酸或焦砷酸与冷水反应同样可以生成砷酸。另外,湿润的砷单质可与臭氧反应生成砷酸
- 2 As + 3 H2O + 5 O3 → 2 H3AsO4 + 5 O2
性质
[编辑]物理性质
[编辑]砷酸固体在空气中很快吸潮,产生水合物 H3AsO4 · ½H2O 或 H3AsO4 · 2H2O (于 −30 °C)。平稳加热时,脱水产生三砷酸(H5As3O10)。加热至100°C时,分解为 As2O5 · 1.66H2O。在500°C时全部失水。[1]
饱和水溶液浓度约 80 %。
毒性虽不及亚砷酸,但仍较高。LD50(兔)为6 mg/1 kg。[4]砷酸与砷酸盐在日本被列为医药用外毒物。
化学性质
[编辑]无水物结晶溶于水时微吸热。(忽略电离)[5]。
- H3AsO4(s) H3AsO4(aq), ΔH°= 3.8 kJ mol-1
砷酸水溶液的氧化性不强,但比同族的磷酸强。这与其他第4周期元素的含氧酸相似,如硒酸、高溴酸,其氧化性均强于对应的硫酸与高氯酸。[6]
- H3AsO4(aq) + 2 H+(aq) + 2 e- = H3AsO3(aq) + H2O(l), E°= 0.575 V
例如砷酸可将碘离子氧化为碘:
- H3AsO4 + 2 H+ + 2 I− → H3AsO3 + I2 + H2O
此外还有焦砷酸(H4As2O7)与多砷酸(Hn+2AsnO3n+1、(HAsO3)n)。这两者及其酸根离子在水溶液中都是不稳定的,遇水很快分解为砷酸。焦砷酸与多砷酸盐在固态可以是稳定的。
水溶液中的电离平衡
[编辑]砷酸分子在水溶液中分三步解离,第一步为微强,0.1mol dm-3水溶液的电离度约0.25。第二步与第三步解离很弱,在酸性溶液中可以忽视。
- H3AsO4(aq) + H2O(l) H3O+(aq) + H2AsO4-(aq), pKa1 = 2.24
- H2AsO4-(aq) + H2O(l) H3O+(aq) + HAsO42-(aq), pKa2 = 6.96
- HAsO42-(aq) + H2O(l) H3O+(aq) + AsO43-(aq), pKa3 = 11.50
| 第一解离 | -7.07 kJ mol-1 | 12.84 kJ mol-1 | -66.9 J mol-K-1 |
|---|---|---|---|
| 第二解离 | 3.22 kJ mol-1 | 38.57 kJ mol-1 | -118.7 J mol-1K-1 |
| 第三解离 | 18.20 kJ mol-1 | 66.19 kJ mol-1 | -161.1 J mol-1K-1 |
砷酸根
[编辑]
砷酸电离可产生三种阴离子:正砷酸根离子(AsO43-)、一氢砷酸根离子(HAsO42-)与二氢砷酸根离子(H2AsO4-)。三种阴离子的盐类均已获得。正砷酸根离子为正四面体结构,类似磷酸根离子;As-O键长169pm。酸液中有微弱的氧化性。
砷酸盐
[编辑]各种砷酸盐可通过用不同计量的碱中和砷酸获得。可溶金属盐与砷酸钠或砷酸氢钠发生复分解,亦可得不可溶的砷酸盐沉淀。
焦砷酸(H4As2O7)与焦磷酸不同,不可通过砷酸加热脱水制得,只能由砷酸氢盐失水得到。
砷酸钠(Na3AsO4)水溶液呈碱性(pH~12)、砷酸一氢钠(Na2HAsO4)水溶液呈弱碱性(pH~9)、砷酸二氢钠(NaH2AsO4)水溶液则呈弱酸性(pH~4.4)。
砷酸钙(Ca3(AsO4)2)用作杀虫剂。砷酸钠可作除草剂,对作物应用效果显著。[1]
正砷酸盐中,碱金属盐、铵盐可溶于水,碱土金属盐等其他盐类则难溶。
砷酸盐矿物
[编辑]
砷酸盐矿物可由含砷的硫化矿物经氧化生成,也可由磷酸盐矿物中的磷酸根被砷酸根替换而得。砷酸盐矿物例子如下:
- 水砷锌矿,Adamite (Zn2(AsO4)(OH))
- 橄榄铜矿,Olivenite (Cu2(AsO4)(OH))
- 钴华,Erythrite (Co3(AsO4)2・8H2O)
- 镍华,Annaberigite (Ni3(AsO4)2・8H2O)
- 臭葱石,Scorodite (FeAsO4・2H2O)
- 绿铅矿,Mimetite (Pb5Cl(AsO4)3)
应用
[编辑]砷酸可用作木材防腐剂、广谱生物杀灭剂、玻璃和金属的整理剂,并可参与合成部分染料及一些有机砷化合物。但砷酸毒性强烈,故其商业应用受到了限制。选兔作为实验对象时,砷酸的半致死量为6 mg/kg(0.006 g/kg)[7]。
参考
[编辑]- ^ 1.0 1.1 1.2 化学大辞典编集委员会 ‘化学大辞典’ 共立出版、1993年
- ^ 2.0 2.1 G. Brauer (编). Arsenic Acid. Handbook of Preparative Inorganic Chemistry 1 2nd. New York: Academic Press. 1963: 601.
- ^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 601.
- ^ Merck Index 13th
- ^ 5.0 5.1 D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982)
- ^ FA コットン, G. ウィルキンソン著, 中原 胜俨訳 ‘コットン・ウィルキンソン无机化学’ 培风馆、1987年,原书:F. ALBERT COTTON and GEOFFREY WILKINSON, Cotton and Wilkinson ADVANCED INORGANIC CHEMISTRY A COMPREHENSIVE TEXT Fourth Edition, INTERSCIENCE, 1980.
- ^ Joachimoglu, G. Biochemische Zeitschrift. 1915, 70: 144. 缺少或
|title=为空 (帮助)
| |||||||
|












