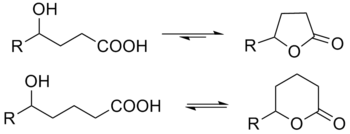
內酯

內酯(英文:Lactone)即環狀的酯,[1]由一化合物中的羥基和羧基發生分子內縮合環化得到。內酯以五元(γ-內酯)及六元(δ-內酯)環內酯最為穩定,環內的角張力最小。4-羥基酸(R-CH(OH)-(CH2)2-COOH)在室溫及稀酸存在下,便自發酯化形成五元環內酯。其他元數的內酯,如β-、ε-內酯,也可以製得,但不及以上二者穩定。
大環內酯是內酯的一類,分子內環元數較大,有很多是藥物的成分。
命名
[編輯]用傳統方法命名內酯時,拆開內酯得到母體化合物羥基酸,將羧基(-COOH)旁的第一個碳原子定為α-位,第二個定為β-,第三個定為γ-,第四個定為δ-,依此類推。名稱由成環羥基所處的位置、「-」、環內碳原子的個數及「內酯」二字構成。例子如γ-丁內酯(4-羥基丁酸形成的五元環內酯)。
內酯的IUPAC名稱是將上述名稱中的希臘字母用數字代替,α-、β-、γ-、δ-分別對應2-、3-、4-、5-。γ-丁內酯的IUPAC名稱為「4-丁內酯」。
合成
[編輯]內酯可通過多種方法合成,最常見的是羥基酸(例如葡萄糖酸)發生分子內酯化:
用硝酸氧化糖類得到羥基酸,而後酯化得到內酯。如下圖的葡萄糖酸雙內酯:
或用其他方法先製得羥基酸。如合成氧甲氫龍時,生成內酯的一步為還原-酯化反應:[2][3]
環酮發生拜耳-維立格氧化重排反應得到內酯:
鹵內酯化反應(Halolactonization):鹵素進攻烯烴發生親電加成的碳正離子中間體與分子內的羧基反應生成內酯,例子見下圖。[4]一個相似的反應是鹵內酰胺化反應。
反應
[編輯]內酯的化學性質與酯相似。除五元環內酯外,所有的內酯在催化劑作用下都會發生開環聚合反應。
水解
[編輯]內酯與鹼(如氫氧化鈉)共熱會發生水解,生成母體羥基酸,是內酯合成的逆反應。不同內酯發生水解的程度不同,有些是可逆反應,一般反應的平衡常數要大於對應的直鏈酯類,水解更加容易,原因是兩者反應的焓變相差不大,但內酯的水解在熵變上有利。
內酯加酸亦會水解生成相應的羥基酸。
還原
[編輯]內酯可被氫化鋁鋰在乾醚中還原為二醇,反應機理是先打斷酯鍵,然後還原生成的羧酸為醇。用γ-丁內酯反應,得到1,4-丁二醇—(CH2(OH)-(CH2)2-CH2(OH)。
氨解
[編輯]內酯可以和氨的乙醇溶液發生氨解反應,酯鍵打斷,生成相應的羥基酰胺。γ-丁內酯反應生成CH2(OH)-(CH2)2-CO-NH2。
例子
[編輯]-
γ-丁內酯 (GBL)
參見
[編輯]參考資料及注釋
[編輯]- ^ March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure Michael B. Smith, Jerry March Wiley-Interscience, 5th edition, 2001, ISBN 0-471-58589-0
- ^ Development of a Commercial Process to Produce Oxandrolone John E. Cabaj, David Kairys, and Thomas R. Benson Org. Process Res. Dev.; 2007; 11(3) pp 378 - 388; (Article) doi:10.1021/op060231b
- ^ 反應中,發生酮的溴代生成鄰鹵代酮,與氯化鋰作用發生消除反應生成α,β-不飽和酮,四氧化鋨和四乙酸鉛氧化開環,用硼氫化鈉還原醛為醇,最後發生分子內成環,得到內酯。
- ^ Organic Syntheses, Coll. Vol. 7, p.164 (1990); Vol. 64, p.175 (1986) Article link (頁面存檔備份,存於網際網路檔案館).