原核細胞骨架
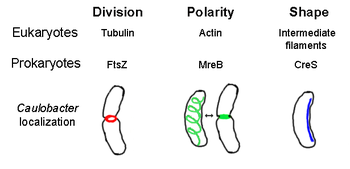
原核細胞骨架(英語:prokaryotic cytoskeleton)是原核生物中所有結構纖維的總稱。人們曾經認為,原核生物沒有細胞骨架,但隨着可視化技術和結構測定的進展,FtsZ在1990年代初的發現改觀了這一認識[2]。並不是所有原核細胞骨架都是真核細胞中骨架蛋白的類似物,一些沒有真核同源物的原核骨架元件也已發現[3][4][5][6] 。這些細胞骨架元件在各種原核生物的細胞分裂與保護,細胞極性與形態決定中有着不可或缺的作用[7][8]。
FtsZ
[編輯]FtsZ是第一個被發現的原核細胞骨架蛋白,組裝在接下來會發生細胞分裂,形成隔板的Z-環上,類似真核生物的肌動蛋白-肌球蛋白收縮環[2]。Z-環是一種高度動態的結構,由許多伸展和收縮的原絲束組成,儘管Z-環收縮背後的機制和所涉及的原絲數量尚不清楚[1]。 FtsZ作為一種組織者蛋白(an organizer protein),是細胞分裂所必需的。 它是胞質分裂期間隔膜的第一個組成部分,它將所有其他已知的細胞分裂蛋白募集到分裂部位[9]。
儘管與肌動蛋白具有這種功能相似性,但FtsZ與真核微管蛋白同源。 儘管FtsZ和微管蛋白的一級結構的比較顯示出弱關係,但它們的三維結構非常相似。 此外,與微管蛋白一樣,單體FtsZ與GTP結合併與其他FtsZ單體聚合,GTP水解的機制類似於微管蛋白二聚化[10]。
MreB
[編輯]MreB是一種被認為類似於真核肌動蛋白的細菌蛋白質。 MreB和肌動蛋白具有弱的一級結構匹配,但在3-D結構和長絲聚合方面非常相似。
幾乎所有的非球形細菌都依賴MreB來確定它們的形狀。 MreB在細胞質膜下組裝成絲狀結構的螺旋網絡,覆蓋細胞的整個長度[11]。 MreB通過介導合成肽聚糖的酶的位置和活性來確定細胞形狀,並通過作為細胞膜下的剛性細絲起作用,施加向外的壓力來雕刻和支撐細胞[1]。 MreB從其正常的螺旋網絡凝結,並在細胞分裂前在新月柄桿菌(Caulobacter crescentus)的隔膜(septum)處形成緊密環,這是一種機制被認為有助於定位其偏離中隔的隔膜[12]。 MreB對於極性細菌中的極性測定也很重要,因為它負責在新月柄桿菌中正確定位至少四種不同的極性蛋白[12]。
Crescentin
[編輯]ParM and SopA
[編輯]MinCDE system
[編輯]Bactofilin
[編輯]Crenactin
[編輯]另見
[編輯]參考文獻
[編輯]- ^ 1.0 1.1 1.2 Gitai, Z. The New Bacterial Cell Biology: Moving Parts and Subcellular Architecture. Cell. 2005, 120 (5): 577–586 [2014-01-09]. PMID 15766522. doi:10.1016/j.cell.2005.02.026. (原始內容存檔於2021-02-13).
- ^ 2.0 2.1 Bi, E.; Lutkenhaus, J. FtsZ ring structure associated with division in Escherichia coli. Nature. 1991, 354 (6349): 161–164. PMID 1944597. doi:10.1038/354161a0.
- ^ Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC. The evolution of compositionally and functionally distinct actin filaments. Journal of Cell Science. June 2015, 128 (11): 2009–19. PMID 25788699. doi:10.1242/jcs.165563.
- ^ Popp D, Narita A, Lee LJ, Ghoshdastider U, Xue B, Srinivasan R, Balasubramanian MK, Tanaka T, Robinson RC. Novel actin-like filament structure from Clostridium tetani. The Journal of Biological Chemistry. June 2012, 287 (25): 21121–9. PMC 3375535
 . PMID 22514279. doi:10.1074/jbc.M112.341016.
. PMID 22514279. doi:10.1074/jbc.M112.341016.
- ^ Popp D, Narita A, Ghoshdastider U, Maeda K, Maéda Y, Oda T, Fujisawa T, Onishi H, Ito K, Robinson RC. Polymeric structures and dynamic properties of the bacterial actin AlfA. Journal of Molecular Biology. April 2010, 397 (4): 1031–41. PMID 20156449. doi:10.1016/j.jmb.2010.02.010.
- ^ Wickstead B, Gull K. The evolution of the cytoskeleton. The Journal of Cell Biology. August 2011, 194 (4): 513–25. PMC 3160578
 . PMID 21859859. doi:10.1083/jcb.201102065.
. PMID 21859859. doi:10.1083/jcb.201102065.
- ^ Shih YL, Rothfield L. The bacterial cytoskeleton. Microbiol. Mol. Biol. Rev. 2006, 70 (3): 729–54. PMC 1594594
 . PMID 16959967. doi:10.1128/MMBR.00017-06.
. PMID 16959967. doi:10.1128/MMBR.00017-06.
- ^ Michie KA, Löwe J. Dynamic filaments of the bacterial cytoskeleton (PDF). Annu. Rev. Biochem. 2006, 75: 467–92 [2014-01-09]. PMID 16756499. doi:10.1146/annurev.biochem.75.103004.142452. (原始內容 (PDF)存檔於2006-11-17).
- ^ Graumann PL. Cytoskeletal elements in bacteria. Current Opinion in Microbiology. December 2004, 7 (6): 565–71. PMID 15556027. doi:10.1016/j.mib.2004.10.010.
- ^ Desai A, Mitchison TJ. Tubulin and FtsZ structures: functional and therapeutic implications. BioEssays. July 1998, 20 (7): 523–7. PMID 9722999. doi:10.1002/(SICI)1521-1878(199807)20:7<523::AID-BIES1>3.0.CO;2-L.
- ^ Kürner J, Medalia O, Linaroudis AA, Baumeister W. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography. Experimental Cell Research. November 2004, 301 (1): 38–42. PMID 15501443. doi:10.1016/j.yexcr.2004.08.005.
- ^ 12.0 12.1 Gitai Z, Dye N, Shapiro L. An actin-like gene can determine cell polarity in bacteria. Proceedings of the National Academy of Sciences of the United States of America. June 2004, 101 (23): 8643–8. PMC 423248
 . PMID 15159537. doi:10.1073/pnas.0402638101.
. PMID 15159537. doi:10.1073/pnas.0402638101.
