螺桨烷

螺桨烷是一类三环有机化合物,三个环共用一个碳碳共价键。它们的特征包括:有碳为反向四面体构型、空间张力很大以及反应活性很高,因此在有机化学中被广泛研究。此类化合物是因为其形状类似螺旋桨而得名。
最简单的螺桨烷是[1.1.1]螺桨烷(C5H6)和[2.2.2]螺桨烷(C8H12)。1,3-去氢金刚烷既是金刚烷家族中的一员,也是[1.3.3]螺桨烷的衍生物。
[1.1.1]螺桨烷
[编辑]1982年,人们首次成功合成[1.1.1]螺桨烷[1]。合成办法是首先将二环[1.1.1]戊烷中的1,3-二羧酸1通过Hunsdiecker反应转化为对应的二溴化合物2,接下来在丁基锂的存在下,发生偶联反应。最后产物在-30°C下,通过柱色谱法分离提纯。如图一所示:
![图一:合成[1.1.1]螺桨烷](http://upload.wikimedia.org/wikipedia/commons/thumb/7/78/111propellaneSynthesis.png/400px-111propellaneSynthesis.png)
另外一个合成方法是将一个二溴卡宾加到3-氯-2-氯甲基丙烯6的双键上,在甲基锂的作用下,中间产物7发生去质子作用和亲核取代反应,生成[1.1.1]螺桨烷。[2] 生成物仅能在−196°C存在于溶液中。
螺桨烷的不稳定性是由于它可以在114°C受热异构化生成3-亚甲基环丁烯5,半衰期仅有5分钟。它也可以自发的与乙酸反应,生成环丁烷4。
聚合
[编辑][1.1.1]螺桨烷是棒烷的单体。[3] 由甲酸甲酯和过氧化苯甲酰引发的自由基聚合反应通常得到低聚物,如图二所示。而由丁基锂引发的阴离子加成聚合反应能得到真正意义上的高聚物。通过X射线衍射证明,聚合物中的C-C键只有一种键长,即148pm。

[2.2.2]螺桨烷
[编辑]1973年,在成功合成[1.1.1]螺桨烷之前,由合成立方烷而著名的菲利普·伊顿小组已经成功合成了[2.2.2]螺桨烷[4]
其合成路径(图三)使用了两次Wolff重排反应。
![图三:合成[2.2.2]螺桨烷](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cb/222propellaneSynthesis.png/400px-222propellaneSynthesis.png)
这个螺桨烷也不稳定,室温下在溶液中的半衰期为28分钟,异构化生成单环氨基化合物11。其环张力估计为390千焦/摩尔。
1,3-去氢金刚烷
[编辑]1,3-去氢金刚烷或称四环[3.3.1.13,7.01,3]癸烷是一个金刚烷家族中的[1.3.3]螺桨烷,可以通过氧化1,3-二卤金刚烷制备。[5]。与其他小螺桨烷一样,1,3-去氢金刚烷也不稳定。在溶液中能与空气中的氧发生反应,生成一个过氧化物,半衰期为6小时。后者和氢化铝锂反应生成一个二羟基化合物。

聚合
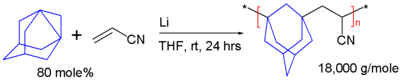
[编辑]正如其他螺桨烷,去氢金刚烷也能够聚合。如图五所示,在四氢呋喃中,由金属锂引发,它与丙烯腈通过自由基聚合链式反应生成一个共聚物,其玻璃转化温度为217°C[6]
另见
[编辑]参考文献
[编辑]- ^ [1.1.1]Propellane Kenneth B. Wiberg and Frederick H. Walker J. Am. Chem. Soc.; 1982; 104(19) pp 5239 - 5240; doi:10.1021/ja00383a046.
- ^ Organic Syntheses, Coll. Vol. 10, p.658 (2004); Vol. 75, p.98 (1998) Online article (页面存档备份,存于互联网档案馆).
- ^ [n]Staffanes: a molecular-size "Tinkertoy" construction set for nanotechnology. Preparation of end-functionalized telomers and a polymer of [1.1.1]propellane Piotr Kaszynski and Josef Michl J. Am. Chem. Soc.; 1988; 110(15) pp 5225 - 5226; doi:10.1021/ja00223a070
- ^ [2.2.2]Propellane system Philip E. Eaton and George H. Temme J. Am. Chem. Soc.; 1973; 95(22) pp 7508 - 7510; doi:10.1021/ja00803a052
- ^ Tetracyclo[3.3.1.13,7.01,3]decane. Highly reactive 1,3-dehydro derivative of adamantane Richard E. Pincock and Edward J. Torupka J. Am. Chem. Soc.; 1969; 91(16) pp 4593 - 4593; doi:10.1021/ja01044a072
- ^ Formation of Alternating Copolymers via Spontaneous Copolymerization of 1,3-Dehydroadamantane with Electron-Deficient Vinyl Monomers Shin-ichi Matsuoka, Naoto Ogiwara, and Takashi Ishizone J. Am. Chem. Soc.; 2006; 128(27) pp 8708 - 8709; (Communication) doi:10.1021/ja062157i
