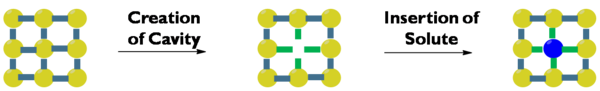
溶剂化

溶剂化[1][2]又称溶剂合[3]、溶合作用[4],是指物质在溶剂中溶解时,溶剂分子与溶质分子或离子、原子间的相互结合,使溶质改变原来的状态、最终形成溶液的过程。[5]
溶剂化、溶解和溶解度的不同
[编辑]由国际纯粹与应用化学联合会 (IUPAC)定义[6],溶剂化是指溶质和溶剂之间的交互作用,使溶质在溶液中稳定[7]。根据溶剂中,离子被溶剂分子环绕,或是形成复合体,可以用来表示溶剂的状态(参考 溶剂壳)[需要解释]。溶剂化的观念,也可应用于不溶的物质,例如,离子交换树脂表面的官能团溶剂化。
在观念上,溶剂化和溶解以及溶解度是不同的。溶解为化学动力学的过程,借由其速率量化。当溶解率和沉淀率相等时,溶解度达到动态平衡的状态。
借由单位可以更了解三者之间的差异性。配位作用可透过配位数复杂的平衡常数来描述。溶解的单位为mol/s,而溶解度的单位为mol/kg。
溶剂化的不同,也在于液化伴随着不可逆的化学改变。例如:锌不可被盐酸溶剂化,但它可借由化学反应,形成可溶的氯化锌盐。
溶剂化与分子间的交互作用
[编辑]极性溶剂为包含键偶极矩的分子结构。此种化合物通常具有很高的介电常数(又称:相对电容率)。溶剂的这些极性分子可以溶剂化离子,因为他们可以使带有部分电荷的分子朝向离子以回应静电吸引。这种现象稳定了系统也创造出一溶剂壳结构(或是水溶液中形成水合结构)。水是最常见且最稳定的极性溶剂。但也有其他的溶剂,例如:乙醇、甲醇、丙酮、乙腈、二甲基亚砜、碳酸亚丙酯。这些溶剂可用来溶解非有机化合物,像是盐类。
溶剂化牵涉到许多不同形式的分子间交互作用:氢键、离子偶极矩和分子间作用力或范德华力。氢键、离子偶极矩,只会发生于极性溶剂。离子和离子间的作用力,只会发生于离子溶剂。偏向热力学的溶剂化反应,只会发生于溶液的吉布斯能降低时,比较溶剂和固体(或是气体或液体)分离的 Gibbs energy。这代表焓的改变量减熵的改变量(乘以绝对温度)为负值,或是指系统的 Gibbs free energy 降低。
溶液的导电率和离子的溶剂化有关。水合反应也影响生物分子电子和震动的性质。[8][9]
热力学方面的考量
[编辑]对于溶剂化的发生,需要能量解开现存晶格中的个别离子及分子。对于打断离子之间的吸引力这是非常重要的,等同于固体晶格的自由能(为离子互相键结,而形成晶格的能量释放)。这个能量来自晶格的离子和溶剂中分子有关联时所释放的能量。这种形式的能量释放称为溶剂化的自由能。
溶液中的溶解热为,溶液中的热焓减掉分离系统的热焓,而熵则是对应到不同的熵。大部分的气体有负的溶解热。而负的溶解热代表溶质在高温时不易溶解。
虽然早期的想法为,离子半径越高比例的阳离子带电,或是电荷密度,会造成较多的溶剂化反应产生。这种想法,对于像是三价的铁或是镧系元素和锕系元素,为较易快速行水合反应而形成不溶的水合氧化物的元素,是不符合的。作为固体,明显的无法进行溶剂化反应。
溶解热可以帮助解释为什么有些离子晶格可以进行溶剂化反应,而有些不行。不同的能量对于一晶格离子之间的释放与溶剂分子之间的结合,称为溶解热。溶液的热焓如果为负,表示可能可溶解;而如果为正,则表示溶剂化不会发生。如果要使为正数的热焓,发生溶剂化反应的话,就必须加入额外的能量,在离子分离时提高熵值。额外加入的熵,会使单独计算物质是否溶解变得困难。溶剂的定量测量是借由donor number所测。
一般来说,热力学的溶液分析,是借由反应作为标准来分析的。例如:如果加氯化钠到水中,则此盐类,会离解成钠离子和氯离子。此离解的平衡方程式可以借由改变反应的Gibbs free energy来预测。
Max Born已经写出第一个离子化合物的溶剂化定量标准。
参见
[编辑]参考资料
[编辑]- ^ 存档副本. [2023-08-01]. (原始内容存档于2023-08-01).
- ^ 存档副本. [2023-08-01]. (原始内容存档于2023-08-01).
- ^ 存档副本. [2023-08-01]. (原始内容存档于2023-08-01).
- ^ 存档副本. [2023-08-01]. (原始内容存档于2023-08-01).
- ^ 赵克健主编,现代药学名词手册,中国医药科技出版社,2004.10,第638页
- ^ IUPAC Compendium of Chemical Terminology, Electronic version, http://goldbook.iupac.org/S05747.html (页面存档备份,存于互联网档案馆)
- ^ 国际纯化学和应用化学联合会,化学术语概略,第二版。(金皮书)(1997)。在线校正版: (2006–) "solvation"。doi:10.1351/goldbook.S05747
- ^ Alireza Mashaghi et al., Hydration strongly affects the molecular and electronic structure of membrane phospholipids. J. Chem. Phys. 136, 114709 (2012) 存档副本. [2012-05-17]. (原始内容存档于2016-05-15).
- ^ Mischa Bonn et al., Interfacial Water Facilitates Energy Transfer by Inducing Extended Vibrations in Membrane Lipids, J Phys Chem, 2012 http://pubs.acs.org/doi/abs/10.1021/jp302478a (页面存档备份,存于互联网档案馆)