生物组织光学窗口
生物组织光学窗口[1](或近红外窗口、治疗窗口)指的是光在生物组织内穿透深度达到最大值的波长区间,一般处于近红外波长范围内。在可见-近红外波段,散射是光与组织间最主要的作用形式,导致光在传播过程中迅速弥散。由于散射增大了光子在组织内的传播距离,因而光子为组织所吸收的概率也随之增大。实际上,散射效应随波长变化很小,因此,生物组织光学窗口的范围主要受限于组织的吸收,其下限(短波长一端)由血液吸收所决定,上限(长波长一端)则由水的吸收所决定。对于光学成像和光热治疗等应用而言,选择位于光学窗口波长范围内的合适光源,对于提高成像(治疗)效率、提高穿透深度、降低光致组织损伤,有着十分重要的意义。
生物组织各组分的吸收
[编辑]
吸收系数()指光子通过单位距离时被吸收的概率[3]。组织的不同组分有着不同的值;同时,还是波长的函数。另外,摩尔消光系数()也是用来衡量组织吸收性质的重要参数,可以从计算得到。组织内不同发色团的吸收性质将在下面讨论。
血液
[编辑]血液中含有两种形式的血红蛋白:氧合血红蛋白()与氧分子结合,而脱氧血红蛋白() 则不与氧分子结合。图1显示了归一化后的氧合血红蛋白和脱氧血红蛋白的吸收光谱。在420纳米、580纳米处,() 分别达到最大和次大的摩尔消光系数峰值,在580纳米以上其消光则随波长上升而下降;()表现出类似的趋势,不同的是其在410纳米处达到最大消光峰,在550纳米和600纳米处达到次大消光峰。而在600纳米以上波长,()摩尔消光系数的降低要比() 更快。与摩尔消光系数曲线相交的点称为等吸收点。
原则上,通过测定一份血样在两个不同波长下的吸收系数,就可以根据下式计算出血样中氧合血样蛋白和脱氧血红蛋白的浓度:

其中,和表示两个不同的波长;和分别是和的摩尔消光系数;和则分别是和的浓度。血氧饱和度()可表示为
水
[编辑]尽管水对于可见光几乎透明,但在近红外区则有着较强的吸收。考虑到组织中水所占的比例之高,水也就成了影响组织光学穿透性的关键组分之一。水在250-1000纳米范围内的吸收光谱见图2。
对组织总吸收贡献较小的其他组分则包括了黑色素和脂肪等。

黑色素
[编辑]黑色素是一种存在于皮肤中表皮层内的发色团,能够避免组织受到有害的紫外线照射。当黑素细胞受到阳光照射刺激时,就会产生黑色素[6]。在某些组分中,黑色素是最强的光吸收体,不过由于浓度较低,其对总吸收的贡献往往小于其他组分。黑色素可以分为两类:黑/棕色的真黑色素和红/黄色的褐黑素[7]。二者的消光光谱见图3。
脂肪
[编辑]尽管吸收较弱,脂肪也是组织中浓度较高的组分之一(10%-40%)。哺乳动物的脂肪吸收光谱很少被报道,图4显示了经过提纯的猪油的吸收光谱。

生物组织各组分的散射
[编辑]光学散射发生在组织内部折射率发生变化处,而这可能出现在从细胞膜到细胞内部的任何地方。一般来说,细胞核和线粒体是细胞中最重要的散射体[3],这些散射体的尺寸可以从100纳米至6微米不等。而这类在细胞器上发生的散射大多是前向散射[6]。
生物组织内的散射一般用散射系数来表示。与吸收系数的定义相似,它指的是光子在穿过单位距离时发生散射的概率。
有效衰减系数
[编辑]组织吸收与散射所导致的光衰减可以用有效衰减系数 ()表示:

其中称为传播散射系数,定义为
这里表示组织的各向异性,一个典型的取值是0.9。图5显示了乳房组织中的传播散射系数随波长的变化,可以看出该系数与波长见大致存在[9]的依赖关系。当组织深度较深( >> 1/ )时,有效衰减系数的大小将决定光在组织内的穿透深度。
生物组织光学窗口范围的估计
[编辑]基于组织吸收光谱或有效衰减系数光谱,可以对光学窗口的范围加以估计。具体说来,在不同类型组织中,光学窗口的范围也会有一定的变化。这不仅是由于不同组织中的血红蛋白总含量不同,也与不同组织中的血氧饱和度差异关系甚大。以下是几个例子,在这些例子中血红蛋白浓度均假定为2.3毫摩尔/升。
吸收系数最小值点λmin = 686 nm; 光学窗口 = (634 - 756) nm.
有效衰减系数最小值点λmin = 690 nm; 光学窗口 = (618 - 926) nm.吸收系数最小值点λmin = 730 nm; 光学窗口 = (664 - 932) nm.
有效衰减系数最小值点λmin = 730 nm; 光学窗口 = (630 - 1328) nm.
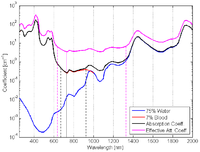
动脉的吸收光谱: ≈ 98%(动脉血氧饱和度)。在此情形下氧合血红蛋白占据主导地位,其吸收对吸收光谱(黑线)和有效衰减系数光谱(紫线)都提供了主要的贡献(见图6a)。
静脉的吸收光谱: ≈ 60%(静脉血氧饱和度)。在此情形下氧合血红蛋白与脱氧血红蛋白的贡献相当。
乳房组织的吸收光谱:要定义(乳房组织的血样饱和度),就需要先了解该组织中动脉血和静脉血的比例。这里采用了动脉血和静脉血之比为20%/80%的经验数字[10]。这样就可以计算出总的血样饱和度为 = 0.2 x + 0.8 x ≈ 70%。
得到上述吸收光谱或有效衰减系数光谱后,通过取倒数就可以获得有效穿透深度曲线(如图7)。判断光学窗口范围的一个有效方法即截取该曲线的半峰全宽。

参见
[编辑]参考文献
[编辑]- ^ Tromberg, B.J., Shah, N., Lanning, R., Cerussi, A., Espinoza, J., Pham, T., Svaasand, L., and Butler, J. (2000). Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia 2, 26–40
- ^ Molar extinction coefficients of oxy and deoxyhemoglobin compiled by Scott Prahl. URL: http://omlc.ogi.edu/spectra/hemoglobin (页面存档备份,存于互联网档案馆).
- ^ 3.0 3.1 LV Wang and HI Wu. Biomedical Optics. Wiley. 2007. ISBN 978-0-471-74304-0.
- ^ G. M. Hale, and M. R. Querry, Optical constants of water in the 200 nm to 200 µm wavelength region, Appl. Opt., 12, 555-563, 1973.
- ^ S. Jacques, Extinction coefficient of melanin. URL: http://omlc.ogi.edu/spectra/melanin/extcoeff.html (页面存档备份,存于互联网档案馆).
- ^ 6.0 6.1 T. Vo-Dinh. Biomedical Photonics Handbook. Taylor & Francis, Inc. 2002. ISBN 0-8493-1116-0.
- ^ George Zonios and Aikaterini Dimou, Ioannis Bassukas, Dimitrios Galaris, and Argyrios Ysolakidis and Efthimios Kaxiras, J. Biomed. Opt., Vol.13, 014017, 2008.
- ^ R.L.P. van Veen, H.J.C.M. Sterenborg, A. Pifferi, A. Torricelli, and R. Cubeddu, OSA Annual BIOMED Topical Meeting, 2004
- ^ 9.0 9.1 S. Srinivasan, B. Pogue, S. Jiang, H. Dehghani, C. Kogel, S. Soho, J. Gibson, T. Tosteson, S. Poplack, and K. Paulsen, K D 2003, Proc Natl Acad. Sci. USA 100 12349 54.
- ^ S. Nioka, S. Wen, J. Zhang, J. Du, X. Intes, Z. Zhao, and B. Chance, Simulation study of breast tissue hemodynamics during pressure perturbation. Oxygen Transport to Tissue XXVI 566, 17-22, 2006.