恩夫韋地
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Fuzeon |
| AHFS/Drugs.com | Monograph |
| 核准狀況 | |
| 懷孕分級 |
|
| 給藥途徑 | 皮下注射(SC) |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 84.3% (經皮下注射) |
| 血漿蛋白結合率 | 92% |
| 藥物代謝 | 經肝 |
| 生物半衰期 | 3.8小時 |
| 排泄途徑 | 尚不明確 |
| 識別資訊 | |
| CAS號 | 159519-65-0 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.169.201 |
| 化學資訊 | |
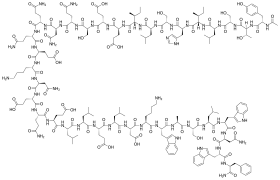
| 化學式 | C204H301N51O64 |
| 摩爾質量 | 4492.1 g/mol |
| 3D模型(JSmol) | |
| |
| |
恩夫韋地(INN:Enfuvirtide),商品名福艾[1](Fuzeon),是一種融合抑制劑類抗愛滋病靶向藥物,由美國的Trimeris公司與瑞士的羅氏公司合作開發。恩夫韋地於2003年得到美國食品藥品監督管理局(FDA)批准上市,是第一種獲FDA批准的融合抑制劑類抗愛滋病藥物[2][3]。恩夫韋地屬於人工合成的多肽類藥物,由36個胺基酸殘基組成。該藥物的作用機制是阻止HIV-1病毒包膜與CD4+ T細胞的質膜融合[4]。臨床上,恩夫韋地需經皮下注射給藥,一般會與其他抗愛滋病藥物聯用,達到控制愛滋病患者病情進展的目的[5][6]。
特性
[編輯]作用機制
[編輯]恩夫韋地屬於融合抑制劑類抗愛滋病藥物,通過阻止HIV-1病毒侵入CD4+ T細胞這一過程發揮藥效。恩夫韋地與HIV-1病毒包膜上的gp41糖蛋白七肽重複區2(HR2)結構相似,因此能干擾gp41的HR1區域和HR2區域結合,達到阻止HIV-1病毒包膜與CD4+ T細胞質膜融合的目的[4][7]。HIV病毒gp41糖蛋白HR1區域內36、38、40,以及43位胺基酸的突變能導致抗藥性的發生[5]。
藥代動力學
[編輯]恩夫韋地經皮下注射給藥,絕對生物利用度為84.3%。以單次90毫克皮下注射為測試條件,半衰期約為3.8±0.6小時,最大血藥濃度為4.59±1.5微克/毫升,需3-12小時(中位數為8小時)達到血藥濃度峰值,擬似分布體積為5.5±1.1升,藥物消除率為24.8±4.1毫克每小時/千克[8]。恩夫韋地主要經肝代謝,不需要針對肝腎功能障礙的病人調整用藥劑量[4][8]。
臨床醫學
[編輯]臨床上,恩夫韋地一般與其他抗愛滋病藥物聯用,用於控制愛滋病患者的病情進展。恩夫韋地一般是對已接受過抗逆轉錄病毒治療的患者使用,不推薦給未接受過類似治療的患者使用恩夫韋地[5][6]。
因恩夫韋地需要一天兩次經皮下注射給藥,恩夫韋地並不是一種常用的藥物[4]。恩夫韋地最常見的藥物不良反應是注射部位疼痛,發生率超過90%,接近100%。除此之外,使用恩夫韋地後,罹患細菌性肺炎的風險也會升高。恩夫韋地也可能導致嗜酸性粒細胞介導的過敏反應(發生概率大約是1%)[9][10][11]。也有使用恩夫韋地後發生噁心、腹瀉、疲勞和失眠等藥物不良反應的報導[5]。
2015年的文獻表明,尚無恩夫韋地與其他藥物發生的相互作用具臨床意義。截至當年,亦未曾有恩夫韋地對孕婦和胎兒影響的正式研究[5]。
歷史
[編輯]恩夫韋地這一藥物的研發基於在杜克大學供職的達尼·博洛涅西(Dani Bolognesi)與他同事的研究。1993年,博洛涅西與幾名同事成立了Trimeris公司。恩夫韋地最初的臨時名稱是「T-20」。1996年,恩夫韋地完成臨床前實驗,進行人體臨床實驗的條件已成熟[12][13]。1999年,Trimeris公司決定與瑞士的羅氏公司合作開發恩夫韋地[14]。2003年3月13日,經過FDA六個月的加速審批,恩夫韋地成功獲批上市,成為第一個獲FDA批准的融合抑制劑類抗愛滋病藥物[3][15]。
商業市場
[編輯]恩夫韋地由Trimeris公司與瑞士的羅氏公司合作開發。根據兩家公司在1999年達成的協議,恩夫韋地在美國和加拿大的利潤由兩家公司平分。羅氏在其他國家銷售恩夫韋地的市場費用由該公司自行承擔,並向Trimeris公司支付特許權使用費[14]。調查表明,2006年第三季度,恩夫韋地的銷售額達到6300萬美元[12]。
恩夫韋地曾因不菲的治療費用而引發爭議。根據2003年的估計,在美國洲接受一年恩夫韋地的治療要花費20,000美元到27,000美元,在歐洲接受一年恩夫韋地的治療要花費超過20,000美元,是當時絕大部分抗愛滋病藥物治療費用的3倍[16][17][18],對大部分人來說,這樣的價格都是無法負擔的[19]。
參見
[編輯]參考文獻
[編輯]- ^ Product Information Fuzeon (PDF). 2007 [2019-01-29]. (原始內容存檔 (PDF)於2019-01-30).
- ^ HB Fung; Y Guo. Enfuvirtide: a fusion inhibitor for the treatment of HIV infection. Clin Ther. 2004, 3 (26): 352–378 [2019-01-29]. PMID 15110129. (原始內容存檔於2018-06-15).
- ^ 3.0 3.1 Drugs@FDA: FDA Approved Drug Products – Fuzeon (Click on 'Approval Date(s) and History, Letters, Labels, Reviews for NDA 021481'). accessdata.fda.gov. United States Food and Drug Administration. [6 January 2019]. (原始內容存檔於2017-06-28).
- ^ 4.0 4.1 4.2 4.3 Eckhardt, Benjamin J.; Gulick, Roy M. Drugs for HIV Infection: 1293–1308.e2. 2017. doi:10.1016/B978-0-7020-6285-8.00152-0.
- ^ 5.0 5.1 5.2 5.3 5.4 Athe M.N.Tsibris; Martin S.Hirsch. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases 1 Eighth Edition. 2015: 1622–1641.e6. doi:10.1016/B978-1-4557-4801-3.00130-2.
- ^ 6.0 6.1 Marzinke, Mark A. Therapeutic Drug Monitoring of Antiretrovirals: 135–163. 2016. doi:10.1016/B978-0-12-802025-8.00006-4.
- ^ Enfuvirtide. Drugbank. [2019-01-29]. (原始內容存檔於2016-12-18).
- ^ 8.0 8.1 Enfuvirtide. Pubchem. [2019-01-29]. (原始內容存檔於2017-10-15).
- ^ Appendix B, Table 5. Characteristics of the Fusion Inhibitor. AIDSinfo. [2019-01-26]. (原始內容存檔於2019-01-26).
- ^ Boyd, Mark; Pett, Sarah. Experimental and clinical pharmacology: HIV fusion inhibitors: a review. Australian Prescriber. 2008, 31 (3): 66–69. ISSN 0312-8008. doi:10.18773/austprescr.2008.040.
- ^ E CARIN. Common Adverse Effects of Antiretroviral Therapy for HIV Disease. American Family Physicians. 2011-06-15, 12 (83): 1443–1451 [2019-01-26]. ISSN 1532-0650. (原始內容存檔於2017-12-06).
- ^ 12.0 12.1 MYRNA F. WATANABE. SUCCESS IN TWO CAREERS. The Scientist. 2007 [2019-01-29]. (原始內容存檔於2020-10-20).
- ^ Louis D., S.; Cervia, J. S.; Smith, M. A. Enfuvirtide (T-20): A Novel Human Immunodeficiency Virus Type 1 Fusion Inhibitor. Clinical Infectious Diseases. 2003, 37 (8): 1102–1106. ISSN 1058-4838. doi:10.1086/378302.
- ^ 14.0 14.1 Trimeris in alliance with Roche. The Business Journal. [2019-01-29]. 原始內容存檔於2002-12-02.
- ^ Roche and Trimeris' HIV drug Fuzeon cleared on schedule by US FDA. The Pharma Letter. [2019-01-29]. (原始內容存檔於2019-01-31).
- ^ Alison Langley; Melody Petersen. Roche Sets High Price in Europe for New AIDS Drug. The New York Times. 2003 [2019-01-29]. (原始內容存檔於2019-04-22).
- ^ Vanessa Fuhrmans. Costly New Drug For AIDS Means Some Go Without. THE WALL STREET JOURNAL. [2019-01-29]. (原始內容存檔於2019-10-08).
- ^ Justine Blau. Anxiety Over Cost Of New AIDS Drug. CBS. [2019-01-29]. (原始內容存檔於2018-09-29).
- ^ New AIDS Drug May Be Too Costly for Many. The Intelligencer. 2003 [2019-01-29]. (原始內容存檔於2019-04-22).
