氫化
此條目需要擴充。 (2011年5月22日) |
| 催化加氫 (Catalysed hydrogenation) | |
|---|---|
| 類型 | 化學 |
| 工業部門 | 食品工業,石油化工,製藥工業,農業 |
| 技術 | 各種過渡金屬催化劑,高壓反應技術 |
| 原料 | 未飽和底物及氫氣或供氫體 |
| 產品 | 飽和烴及其衍生物 |
| 發明者 | 保羅·薩巴捷 |
| 發明年份 | 1897年 |
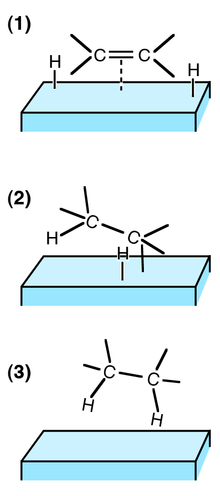
(1) 反應物吸附到催化劑表面,氫氣解離
(2) 一個氫原子加成到雙鍵的一個碳上,另一個碳原子仍附著在表面上
(3) 第二個碳原子加氫,產物分子離開催化劑表面
氫化也稱為加氫,是一種用氫氣和其他化合物反應的單元操作,通常發生在鎳、鈀、鉑等催化劑表面。氫化通常用於還原未飽和的有機化合物或其他化合物。碳氫化合物的氫化可以還原掉分子中的雙鍵和三鍵[1]。典型的氫化過程是烯烴加氫,有一分子的氫氣加入烯烴分子中。由於氫氣不活躍,通常必須有催化劑的存在才能反應,無催化劑的氫化過程只在高溫下才發生。
氫化在化工生產中一般分為兩種:
- 加氫——單純增加有機化合物中氫原子的數目,使不飽和的有機物變為相對飽和的有機物,如將苯加氫生成環己烷以用於製造錦綸;將魚油加氫製作硬化固體油以便與貯藏和運輸;製造合成潤滑油、肥皂、甘油的過程也是一種加氫過程。
- 氫解——同時將有機物分子進行破裂和增加氫原子。如將煤或重油經氫解,變成小分子液體狀態的人造石油,經分餾可以獲得人造汽油。
過程
[編輯]在氫化過程中有三種物質:作為底物的不飽和烷烴、氫氣或者等價的供氫源和必要的催化劑。氫化還原反應發生的溫度、壓力取決於底物的種類和催化劑的活性。
相關及競爭反應
[編輯]氫化反應所需要的催化劑及反應條件也能讓烯烴發生異構化反應,其構型會從順式變為反式。這個過程在食品工業中很重要,因為加氫技術在食物里產生了大量的反式脂肪酸。
原有的化學鍵斷裂,再加上一分子氫氣的反應稱為氫解。氫解可能會導致碳-碳鍵或碳-雜鍵斷裂(雜原子可以是:氧、氮、硫或鹵素)。氫化產物中的極性鍵可能是氫解產生的。
供氫源
[編輯]對於氫化過程,最直接的供氫源就是氫氣,商業上氫氣通常儲存在加壓的鋼瓶中。工業上的氫化過程的壓力通常是一個大氣壓以上,這時需要使用增壓泵將鋼瓶中的氫氣升壓到所需壓力。工業上氫氣的來源是碳氫化合物的蒸汽重整[2]。 許多不直接使用氫氣的情況下,可以用像甲酸、異丙醇、二氫蒽這樣的供氫劑作為供氫源。它們經脫氫反應生成二氧化碳、丙酮和蒽,並還原其他化合物。這樣的反應稱為轉移加氫。
底物
[編輯]烯烴和炔烴加氫的一個重要特徵是順式加成。不論是均相催化還是非均相催化,反應都通過順式加成機理進行,氫氣從位阻最小的地方進攻[3]。加成反應可以在不同的官能團上進行:
| 底物 | 產物 | 備註 | 氫化熱 (kJ/mol)[4] |
|---|---|---|---|
| R2C=CR'2 (烯烴) |
R2CHCHR'2 (烷烴) |
在人造奶油的生產中廣泛應用 | −90 ~ −130 |
| RC≡CR' (炔烴) |
RCH2CH2R' (烷烴) |
部分加氫得到 cis-RHC=CHR' | −300 (加氫至飽和) |
| RCHO (醛) |
RCH2OH (伯醇) |
通常採用轉移加氫 | −60 ~ −65 |
| R2CO (酮) |
R2CHOH (仲醇) |
通常採用轉移加氫 | −60 ~ −65 |
| RCO2R' (酯) |
RCH2OH + R'OH (兩種醇) |
常用於脂肪醇的生產 | −25 ~ −105 |
| RCO2H (羧酸) |
RCH2OH (伯醇) |
用於脂肪醇的生產 | −25 ~ −75 |
| RNO2 (硝基) |
RNH2 (胺) |
主要用於生產苯胺[5][6] | −550 |
催化劑
[編輯]除了少數情況下,在沒有催化劑時,氫氣不會和有機物反應。不飽和的反應底物會化學吸附到催化劑表面,催化劑的大多數表面都被底物占據。在非均相催化反應中,氫氣和催化劑表面形成鍵 (M-H),這樣氫原子就能轉移到已經吸附的底物上。鉑鈀銠和銣均是高活性的催化劑,可以在較低的溫度壓力下操作。貴金屬催化劑雖然活性高,反應條件要求低,但價格太高。基於鎳的非貴金屬催化劑,如蘭尼鎳、漆原鎳等價格較低、更經濟,但反應活性不高,需要在高溫、高壓下反應[7][8]。人們需要在反應活性(反應速度)與催化劑的成本以及使用高壓設備的成本之間權衡,找到合適的平衡點。
催化劑通常按反應體系的相態分為兩類:均相催化和非均相催化。均相催化劑和反應物均溶解在溶劑中。而非均相催化劑是固體,懸浮在溶解有底物的溶劑中,或者與氣體底物反應。
均相催化劑
[編輯]以下列出了有名的均相催化劑。這些催化劑都是配合物,可以同時活化氫氣和不飽和底物。大多數情況下配合物含有鉑系的金屬,如鉑、釕、銥等。
- 均相加氫催化劑和它們的前體
-
三(三苯基膦)二氯化釕(II) 是一種基於銠的預催化劑
-
Crabtree 催化劑是一種含依的高活性催化劑
-
Rh2Cl2(cod)2 是許多均相催化劑的前體
-
(S)-iPr-PHOX 是一種典型的螯合磷酸配體,用於不對稱氫化反應

均相催化劑也用在不對成合成中,通過催化前手性底物加氫可以得到不對成的產物。這種方法最早的證明是銠催化的醯胺氫化反應,產物作為藥物 L-DOPA 的前體[9]。為了實現不對稱還原,催化劑使用手性二膦作為配體[10]。銠催化氫化也被應用於 S-metolachlor 除草劑的生產中,它使用了Josiphos 類型的配體(稱為Xyliphos)[11]。從理論上講,不對稱氫化反應可以被手性非均相催化劑催化[12],但這種方法更多的是一種探索,而不是一項實用的技術。
設備
[編輯]對於氫化過程,化學工程師可以選擇三大類設備:
- 常壓間歇加氫
- 高溫/高壓間歇加氫[13]
- 流動加氫
常壓加氫
[編輯]常壓加氫是最原始的加氫方法。現在仍然用於教學用途。常壓加氫通常在圓底燒瓶中進行,燒瓶口用橡膠圈密封,燒瓶內裝有溶解的反應物和固體催化劑,並用氮氣或氬氣隔絕空氣做保護氣。氫氣通過氫氣球持續加入,並通過不斷攪拌,以促進三相反應物反應。可以通過監視氫氣球的變化或氫氣的吸收來來判斷氫氣的消耗量,進而判斷氫化反應的進行程度。通常使用盛有硫酸銅等有色液體的刻度管來測量氫氣的吸收量,或使用帶有刻度的反應器。
高溫/高壓加氫
[編輯]對於許多氫化反應,如去除保護基團的氫解反應和芳香體系的還原反應,常溫常壓下進行的十分緩慢,對於這種類型的反應一般使用高壓系統。在這種情況下,催化劑添加到惰性氛圍下的壓力容器中,氫氣直接從氣瓶或實驗室的供氫源加入體系中。加壓的漿液體系通過機械搖動進行攪拌混合,或者使用旋轉籃攪拌[13],也可以加熱,讓漿體自行混合,因為壓力彌補了加熱導致的氣體溶解度的降低。
流動加氫
[編輯]流動加氫技術已經成為工業上的一種熱門技術,工業應用規模也逐漸增加。該技術將氫氣和稀釋的溶解於溶液中的反應物連續地通過固定床催化劑。通過使用現有的高效液相色譜技術,系統允許壓力從常壓到加壓至 1,450 psi(100 bar),也可以提高反應溫度。在實驗室級的反應中,可以使用一系列預製的整裝催化劑,使用時無需稱重或去除失效的催化劑。
工業反應器
[編輯]工業上,催化加氫使用裝有已負載催化劑的平推流反應器。操作溫度、壓力通常很高,具體的數值取決於催化劑的種類。相對於實驗室內的催化劑,工業上催化劑在載體上的負載量很低,並且金屬中添加了不同的助劑或使用混合金屬來改善活性、選擇性和穩定性。通常使用金屬鎳,因為鎳相對其它貴金屬是活性低、易於控制且價格便宜。
氣液感應反應器(加氫器)也用於催化加氫[14]。
參考文獻
[編輯]- ^ Hudlický, Miloš. Reductions in Organic Chemistry. Washington, D.C.: American Chemical Society. 1996: 429. ISBN 0-8412-3344-6.
- ^ Paul N. Rylander, "Hydrogenation and Dehydrogenation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a13_487
- ^ Advanced Organic Chemistry Jerry March 2nd Edition
- ^ Scott D. Barnicki "Synthetic Organic Chemicals" in Handbook of Industrial Chemistry and Biotechnology edited by James A. Kent, New York : Springer, 2012. 12th ed. ISBN 978-1-4614-4259-2.
- ^ Hydrogenation of nitrobenzene using polymer bound Ru(III) complexes as catalyst. Ind. Jr. of Chem. Tech. 2000, 7: 280.
- ^ Patel, D. R. Hydrogenation of nitrobenzene using polymer anchored Pd(II) complexes as catalyst. Journal of Molecular Catalysis. 1998, 130: 57. doi:10.1016/s1381-1169(97)00197-0.
- ^ C. F. H. Allen and James VanAllan (1955). "m-Toylybenzylamine". Org. Synth.; Coll. Vol. 3: 827.
- ^ A. B. Mekler, S. Ramachandran, S. Swaminathan, and Melvin S. Newman (1973). "2-Methyl-1,3-Cyclohexanedione". Org. Synth.; Coll. Vol. 5: 743.
- ^ Knowles, W. S. Application of organometallic catalysis to the commercial production of L-DOPA. Journal of Chemical Education. March 1986, 63 (3): 222. Bibcode:1986JChEd..63..222K. doi:10.1021/ed063p222.
- ^ Atkins, Peter W. Shriver & Atkins' inorganic chemistry. 5th. New York: W. H. Freeman and Co. 2010: 696. ISBN 978-1-4292-1820-7.
- ^ Blaser, Hans-Ulrich; Pugin, Benoît; Spindler, Felix; Thommen, Marc. From a Chiral Switch to a Ligand Portfolio for Asymmetric Catalysis. Accounts of Chemical Research. December 2007, 40 (12): 1240–1250. doi:10.1021/ar7001057.
- ^ Mallat, T.; Orglmeister, E.; Baiker, A. Asymmetric Catalysis at Chiral Metal Surfaces. Chemical Reviews. 2007, 107 (11): 4863–90. PMID 17927256. doi:10.1021/cr0683663.
- ^ 13.0 13.1 Adams, Roger; Voorhees, V. Apparatus for catalytic reduction. Organic Syntheses. 1928, 8: 10. doi:10.15227/orgsyn.008.0010.
- ^ Joshi, J.B.; Pandit, A.B.; Sharma, M.M. Mechanically agitated gas–liquid reactors. Chemical Engineering Science. 1982, 37 (6): 813. doi:10.1016/0009-2509(82)80171-1.
外部連結
[編輯]- "The Magic of Hydro" Popular Mechanics, June 1931, pp. 107–109 (頁面存檔備份,存於網際網路檔案館) —— 20世紀30年代,面向大眾介紹石油加氫技術的早期文章。




