1,6-桥亚甲基[10]轮烯:修订间差异
外观
删除的内容 添加的内容
←建立内容为“{{DISPLAYTITLE|1,6-桥亚甲基[10]轮烯}} {{Chembox | Name = 1,6-桥亚甲基[10]轮烯 | ImageFile = 1,6-methanonaphthalene.svg | ImageSize = 150px | PIN = Bicyclo[4.4.1]undeca-1,3,5,7,9-pentaene | OtherNames = | Section1 = {{Chembox Identifiers | CASNo = 2443-46-1 | PubChem = 137603 | ChemSpiderID = 121264 | SMILES = c1ccc2ccccc(c1)C2 | InChI = 1/C11H10/c1-2-6-11-8-4-3-7-10(5-1)9-11/h1-8H,9H2 | InChIKey = OORRQYZWSVJKSO-UHFFFAOYAC |…”的新页面 |
(没有差异)
|
2024年2月3日 (六) 10:55的版本
| 1,6-桥亚甲基[10]轮烯 | |
|---|---|

| |
| IUPAC名 Bicyclo[4.4.1]undeca-1,3,5,7,9-pentaene | |
| 识别 | |
| CAS号 | 2443-46-1 |
| PubChem | 137603 |
| ChemSpider | 121264 |
| SMILES |
|
| InChI |
|
| InChIKey | OORRQYZWSVJKSO-UHFFFAOYAC |
| 性质 | |
| 化学式 | C11H10 |
| 摩尔质量 | 142.2 g·mol−1 |
| 外观 | 无色晶体[1] |
| 熔点 | 28—29 °C(82—84 °F;301—302 K)[1] |
| 结构[2] | |
| 晶体结构 | 正交晶系 |
| 空间群 | Fdd2 |
| 晶格常数 | a = 33.9690 Å, b = 15.1117 Å, c = 6.1811 Å |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
1,6-桥亚甲基[10]轮烯是一种芳香烃,化学式C11H10。它是第一个被发现具有芳香性的环癸五烯衍生物。
制备
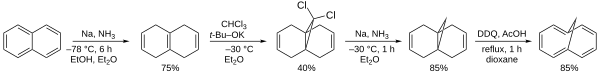
首先通过伯奇还原反应,将萘还原成1,4,5,8-四氢萘,然后与二氯卡宾(由氯仿与叔丁醇钾反应产生)发生加成反应,生成三元环。之后,产物再次被还原,脱去氯原子,最后用2,3-二氯-5,6-二氰对苯醌(DDQ)移除中间的一根键并脱氢,产生1,6-桥亚甲基[10]轮烯。[3]
芳香性
1,6-桥亚甲基[10]轮烯是环癸五烯([10]轮烯)的衍生物,其中两个氢原子被桥联亚甲基(-CH
2-)取代。它遵守休克尔规则(n = 2)。虽然桥联亚甲基使它扭曲,碳环骨架不在同一平面内,但它仍具有芳香性。[4][5]它早在1964年就被发现,[1][6]是第一个被发现具有环癸五烯芳香环的化合物。[5]据X射线分析的结构与核磁共振谱的核独立化学位移发现,1,6-桥亚甲基[10]轮烯中碳-碳键的键长没有单双键键长的交替变化,具有芳香性。[7]
应用
参见
参考资料
- ^ 1.0 1.1 1.2 Vogel, Emanuel; Roth, H. D. The Cyclodecapentaene System. Angew. Chem. Int. Ed. 1964, 3 (3): 228–229. doi:10.1002/anie.196402282.
- ^ Bianchi, R.; Pilati, T.; Simonetta, M. Structure of 1,6-methano[10]annulene. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1980-12-01, 36 (12): 3146–3148. ISSN 0567-7408. doi:10.1107/S0567740880011089.
- ^ Vogel, E.; Klug, W.; Breuer, A. 1,6-METHANO[10]ANNULENE. Organic Syntheses. 1974, 54: 11. doi:10.15227/orgsyn.054.0011.
- ^ Gatti, Carlo; Orlando, Ahmed M.; Monza, Emanuele; Lo Presti, Leonardo. Exploring Chemistry Through the Source Function for the Electron and the Electron Spin Densities. Chauvin, Remi; Lepetit, Christine; Silvi, Bernard; Alikhani, Esmail (编). Applications of Topological Methods in Molecular Chemistry. Challenges and Advances in Computational Chemistry and Physics 22. Springer International Publishing. 2016: 101–129. ISBN 9783319290225. doi:10.1007/978-3-319-29022-5_5.
- ^ 5.0 5.1 Hill, Richard K.; Giberson, Carolyn B.; Silverton, James V. Forfeiture of the aromaticity of a bridged [10]annulene by benzannelation. J. Am. Chem. Soc. 1988, 110 (2): 497–500. doi:10.1021/ja00210a031.
- ^ Vogel, Emanuel; Böll, W. A. Substitution of 1,6-Methanocyclodecapentaene. Angew. Chem. Int. Ed. 1964, 3 (9): 642. doi:10.1002/anie.196406421.
- ^ Slayden, Suzanne W.; Liebman, Joel F. The Energetics of Aromatic Hydrocarbons: An Experimental Thermochemical Perspective. Chemical Reviews. 2001-05-01, 101 (5): 1545–1546. ISSN 0009-2665. doi:10.1021/cr990324+ (英语).
- ^ Roth, Wolfgang R.; Böhm, Manfred. Resonance Energy of Bridged [10]Annulene. Angew. Chem. Int. Ed. 1983, 22 (12): 1007–1008. doi:10.1002/anie.198310071.
- ^ Peart, Patricia A.; Repka, Lindsay M.; Tovar, John D. Emerging Prospects for Unusual Aromaticity in Organic Electronic Materials: The Case for Methano[10]annulene
 . European Journal of Organic Chemistry. May 2008, 2008 (13): 2193–2206. ISSN 1434-193X. doi:10.1002/ejoc.200701102 (英语).
. European Journal of Organic Chemistry. May 2008, 2008 (13): 2193–2206. ISSN 1434-193X. doi:10.1002/ejoc.200701102 (英语).
