质谱解析
质谱解析是指从质谱中识别出化学式、碎片裂解特征、以及其他可能的碎片离子的分析方法[1][2]。质谱图绘制的是质荷比与其对应的相对丰度的关系。电子电离质谱法常用于有机化合物的鉴定[3][4]。有机化学家会将化合物的质谱作为解析化合物结构的一部分;质谱的解谱也是许多有机化学课程的一部分。
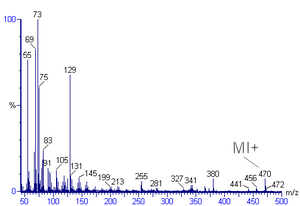
质谱生成[编辑]

电子电离(EI)是常用的一类质谱离子源,采用的是一束电子与气相分子M相互作用形成离子:
表示分子离子[5],上标“+”表示离子电荷,上标“•”表示自由基离子的未成对电子。电子束采用的能量通常为70电子伏特。电离过程一般会引起分子化学键的大量断裂。
电离室的高真空环境致使分子的平均自由程从10厘米到1公里不等,因此裂解可被视为单分子过程。裂解刚开始时,电子先从最低电离能的位置被激发。由于电子能量的顺序是非成键电子 > π 键电子 > σ 键电子,所以被电离的顺序也是非成键电子 > π 键电子 > σ 键电子。 [6]

质谱图中丰度最高的峰称为基峰,对应的通常是分子离子(并非绝对)。对于分子离子的确定可能会是一件较为困难的事情。对于有机化合物,分子离子峰的相对丰度随着分支以及同系物中质量的增加而降低。例如,甲苯的分子离子峰位于 92 m/z 处(对应其分子量)。分子离子峰之前也常常会伴随着一个M-1或M-2峰,分别对应于氢自由基或二氢的丢失。这里的M是指化合物的分子量。在甲苯的谱图中,氢自由基(质子-电子对)丢失,形成的是M-1 (91)峰。
分子的裂解也会形成质量小于分子离子的峰。裂解有许多反应途径,但只有新形成的阳离子(而非自由基碎片或中性碎片)会出现在质谱图中。亚稳态峰(metastable peak)是指位于非整数质量处的丰度较低而展宽的峰。这些峰来自于寿命较短的离子;这些离子的平均寿命短于该离子穿过电离室到达检测器所需的时间。
分子式测定[编辑]
氮规则[编辑]
氮规则规定,对于含有氢、碳、氮、氧、硅、磷、硫或卤素的有机分子,如果氮原子数为奇数,则标称质量(nominal mass)为奇数;如果氮原子数为偶数,则标称质量为偶数[7][8]。适用于氮规则的结构要求分子中的原子的共价键的数量(将每个σ键和π键计算为单独的共价键)等于其标准价数。
环规则[编辑]
从不饱和度原理得出,仅含碳、氢、卤素、氮和氧的分子遵循以下公式
其中 C 是碳原子数,H 是氢原子数,X 是卤素原子数,N 是氮原子数。
偶电子规则[编辑]
偶电子规则指出,具有偶数电子(阳离子但不是自由基离子)的离子倾向于形成偶电子碎片离子,而奇电子离子(自由基离子)则形成奇电子离子或偶电子离子[9]。偶电子组分(even-electron species)倾向于分裂成另一个偶电子阳离子和一个中性分子,而不是两个奇电子组分:
OE +• →EE + + R •, OE +• →OE +• + N
史蒂文森规则[编辑]
产物阳离子越稳定,相应的分解过程就越丰富。可用几种理论来预测裂解过程,例如电子八隅体规则(octet rule)、共振稳定(resonance stabilization)和超共轭(hyperconjugation)等。 [6]
13规则[编辑]
通过13规则中的简单几步,可列出给定分子量可能的化学式[10]。第一步是假设分子中仅存在碳和氢,并且该分子包含一定数量的CH“单元(unit)”,每个单元的标称质量为13。如果所讨论的分子的分子量为M,可能的CH单元数为n,那么有
其中r是余数。分子的基本公式可写为
不饱和度为
u若为负值,表示分子中存在杂原子;若为半整数,则表示分子中存在奇数个氮原子。在添加杂原子时,分子式可以用等价质量的碳和氢来进行调整。例如,添加一个氮原子需要移除一个CH2;添加一个氧原子需要移除一个CH4。
同位素效应[编辑]
谱图中的同位素峰有助于结构解析。含有卤素(尤其是氯和溴)的化合物会产生非常明显的同位素峰。溴甲烷的质谱在m/z 94 (M) 和 96 (M+2) 处有两个丰度相等的突出峰,在79和81处又有两个属于溴片段的峰。
即使化合物仅包含同位素峰丰度较低的元素(碳或氧),也可以将这些峰的分布和正确的化合物对应起来。例如,同为150 Da质量的化合物C8H12N3+和C9H10O2+可根据它们不同的M+2丰度来区分。
裂解[编辑]
除了确定未知化合物的摩尔质量外,电谱的裂解模式也适合提供结构信息,尤其是可以结合分子式(若适用)对不饱和度进行计算。经常丢失的中性碎片有一氧化碳、乙烯、水、氨和硫化氢。裂解过程大致有如下几种:
α - 裂解(α - cleavage)[编辑]
裂解来自于均裂过程。如图所示,该裂解缘于自由基位点的未配对电子与另一键的电子配对到电荷位点相邻原子的趋势[7]。该反应被定义为均裂,因为只有一个电子被转移。这种反应的驱动力是自由基位点的给电子能力:N > S、O、π > Cl、Br > H[11],例如杂原子旁碳-碳键的断裂。示意图中的单电子运动由单向箭头指示。

σ键断裂[编辑]
烷烃的电离削弱了碳-碳键,导致了最终的分解[7]。化学键断裂会产生带电的偶数电子组分 (R+) 和中性自由基组分 (R•)。高度取代的碳正离子比未取代的更稳定。

诱导裂解(Inductive cleavage)[编辑]
如图所示,该反应由自由基位点的诱导作用引起。由于转移了一对电子,因此该反应被定义为异裂(heterolytic cleavage)。 [11]该反应的驱动力是自由基位点的电负性:卤素 > O、S >> N、C,不如自由基位点反应来得常见。 [11]

麦克拉弗蒂重排[编辑]
麦克拉弗蒂重排反应(麦氏重排)发生在含有酮基的分子中,涉及 β-裂解,还伴随着 γ-氢原子的获得[12][13][14]。离子中性复合物(ion-neutral complex)的形成涉及键均裂或键异裂,因为其中的动能不足以分离碎片,所以相互的反应类似于离子-分子反应。
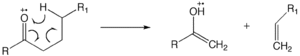
氢重排成饱和杂原子[编辑]
“1,5”氢位移导致一个γ-氢转移到饱和杂原子上的自由基位点。麦氏重排的相同要求适用于氢重排为饱和杂原子。这种重排引发电荷位点反应,导致形成奇电子离子和小中性分子(水或酸等)。对于醇类,这种异裂会释放一个水分子。由于电荷点反应在体积较小的醇中占主导地位,因此利于该反应的醇类排序如下:伯醇>仲醇>叔醇。 [11]
双氢重排[编辑]
“1,5”氢位移导致两个γ-氢转移到两个不一样的不饱和原子上的两个自由基位点。 麦氏重排的相同要求适用于双氢重排。对于三个不饱和官能团,即硫酯、酯和酰胺,观察到该反应。 [15]
正交重排(ortho rearrangement)[编辑]
“1,5”氢位移的相同要求发生在芳环邻位的适当取代基之间。除了较强的 α,β 碳-碳双键外,麦氏重排的相同要求适用于正交重排。这种重排引发电荷位点反应,导致形成奇电子离子和小中性分子(水或 HCl 等)。该反应可用于区分邻位异构体与对位异构体和间位异构体。该反应也可见于三个不饱和官能团,即硫酯、酯和酰胺。 [11]

逆狄尔斯-阿尔德反应[编辑]
该反应主要发生在环己烯及其衍生物中。电离后,π 电子被激发并产生电荷位点和自由基位点,然后两个连续的 α 裂解产生一个丁二烯自由基和一个中性乙烯,因为乙烯比丁二烯具有更高的电离能(史蒂文森规则)。 [11]

裂环反应(Cycloreversion reaction)[编辑]
该反应主要发生在四元环状分子中。一旦被电离,它会产生一个非张力离子,然后进一步分裂以产生一个乙烯自由基离子和一个中性乙烯分子。 [11]
特定化合物类别的裂解模式[编辑]
烷烃[编辑]
对于直链烷烃,经常观察到分子离子峰。然而,对于长链化合物,分子离子峰的丰度往往较低,线性片段通常相差 14 Da (CH2 = 14),例如己烷裂解模式:m/z=57 丁基阳离子是基峰,电离谱中其他丰度最高的峰是 m/z=15、29、43 Da 处的烷基碳阳离子。 [6][2][11]

支链烷烃在电离谱中具有丰度稍低的分子离子峰。它们倾向于在分支点断裂。对于 2,3-二甲基丁烷,异丙基阳离子峰 (m/z=43) 丰度非常高。 [6][2][11]

环烷烃具有相对丰度较高的分子离子峰(两个键必须断裂)。烯烃裂解峰通常是最重要的模式。CH2CH 2 (= 28) 的丢失很常见(如果存在)。然而对于取代的环烷烃,它们更倾向于通过在支化点裂解形成环烷基阳离子。 [11]

烯烃[编辑]
由于 π 电子的电离能低于 σ 电子,因此烯烃通常会产生比烷烃丰度更高的分子离子峰。电离后,双键很容易迁移,导致几乎不可能测定异构体。由于共振稳定,烯丙基裂解是最重要的裂解模式。 [11]

麦氏重排是可能的(类似于羰基 π 键)。同样,化学键迁移(bond migration)是可能的。 [11]

环己烯经常发生逆狄尔斯-阿尔德反应。
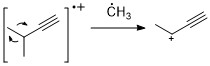
炔烃[编辑]
与烯烃类似,炔烃也常表现出丰度较高的分子离子峰。 Propargylic裂解是最重要的裂解模式。 [11]
芳烃[编辑]
芳烃显示出明显的分子离子峰。苄基裂解很常见。当烷基连接到环上时,常见的裂解模式是失去一个 H 基以形成䓬 (m/z 91)。 [2][11]
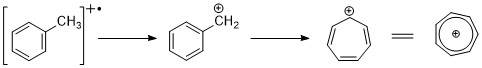
烷基取代的苯可以由动力学主导的过程裂解形成 C6H5+ 、C6H6+离子。 [11]

另一种常见的断裂模式是麦氏重排,它要求烷基链长度至少长于 3 个碳。 [11]

醇类[编辑]
由于氧的强电负性,醇类一般具有丰度较低的分子离子峰。由于共振稳定,α-解理很常见,最大的烷基将被丢掉。 [2]

另一种常见的裂解模式是脱水 (M-18)。对于更长链的醇,麦氏重排反应可以产生水和乙烯 (M-46)。
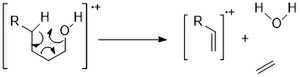
环状醇倾向于显示比线性链丰度更高的 M+ 峰。它们遵循类似的裂解途径:α 裂解和脱水。 [11]
苯酚[编辑]
苯酚常常表现出丰度很高的分子离子峰。H· (M – 1)、CO (M – 28) 和甲酰基 (HCO·, M – 29) 常常被观测到。 [2][11]

醚[编辑]
与相应的醇或烷烃相比,醚会产生丰度略高的分子离子峰。醚有以下两种常见的解理模式:α-裂解和 CO 键裂解。

芳香醚通过失去烷基而不是 H 来生成 C6H5O+ 离子;这可以让酚类在降解过程中丢掉 CO。 [11]

羰基化合物[编辑]
羰基化合物有五种类型,包括醛、酮、羧酸和酯。[2]主要的裂解模式描述如下:
由于氧孤对可以稳定正电荷,因此羰基官能团的任一侧都可以发生 α 裂解。

由于共振稳定,β-裂解是羰基化合物断裂的特征模式。
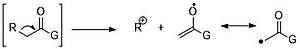
对于较长链的羰基化合物(碳数大于 4),麦氏重排占主导地位。

根据这些裂解模式,羰基化合物的特征峰总结在下表中:
| 观测到的离子 m/z | ||||||
| 裂解 | 路径 | 醛类
G=H |
酮类
G=CH3 |
酯类
G=OCH 3 |
酸
G = O |
酰胺
G = NH2 |
| α-裂解 | R基团的损失 | 29 | 43 | 59 | 45 | 44 |
| α-裂解 | G自由基的丢失 | M-1 | M-15 | M-59 | M-45 | M-44 |
| β-裂解 | M-43 | M-57 | M-73 | M-59 | M-58 | |
| 麦氏重排 | 44 | 58 | 74 | 60 | 59 | |
对于芳香族羰基化合物,常见的α-裂解途径是先失去 G·(M – 1,15, 29...)以形成 C6H5CO+ 离子(m/z=105);进一步则是失去 CO(m/z=77)和 HCCH (m/z=51)。 [6]

胺类[编辑]
胺类遵循氮规则,奇数的分子离子质荷比表明存在奇数个氮。尽管如此,脂肪胺中的分子离子峰的丰度很低,因为在胺旁边很容易发生裂解。 α-裂解反应是胺最重要的裂解模式;对于 1° 正脂肪胺,在 m/z 30 处有一个高丰度的峰。 [11][6]
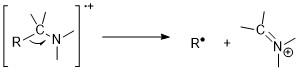
芳香胺具有丰度较高的分子离子峰。对于苯胺,它们更倾向于在丢掉 HCN 之前先失去一个氢原子。

腈类[编辑]
主要的裂解模式是由于共振稳定而从 CN 基团旁边的碳中丢失一个 H 原子 (M – 1)。当它们的链更长时可能会出现麦氏重排。 [6]

硝基化合物[编辑]
脂肪族硝基化合物通常显示出丰度较低的分子离子峰,而芳香族硝基化合物则显示出丰度较高的峰。常见的裂解模式是损失NO+和NO2+ 。 [6]

电喷雾电离和大气压化学电离[编辑]
电喷雾电离和大气压化学电离由于电离机制不同,对质谱解释的规则也不同。 [16]
相关条目[编辑]
参考资料[编辑]
- ^ Terrence A. Lee. A Beginner's Guide to Mass Spectral Interpretation. John Wiley & Sons. 4 February 1998 [2021-12-10]. ISBN 978-0-471-97629-5. (原始内容存档于2017-03-16).
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 Fred W. McLafferty. Interpretation of Mass Spectra. University Science Books. 1 January 1993 [2021-12-10]. ISBN 978-0-935702-25-5. (原始内容存档于2017-03-16).
- ^ Spectrometric identification of organic compounds Silverstein, Bassler, Morrill 4th Ed.
- ^ Organic spectroscopy William Kemp 2nd Ed. ISBN 0-333-42171-X
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "electron ionization"。doi:10.1351/goldbook.E01999
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 Pavia, Donald L. Introduction to spectroscopy. 2015: 141. ISBN 1-285-46012-X.
- ^ 7.0 7.1 7.2 Tureček, František; McLafferty, Fred W. Interpretation of mass spectra. Sausalito, Calif: University Science Books. 1993: 37–38. ISBN 0-935702-25-3.
- ^ David O. Sparkman. Mass Spectrometry Desk Reference. Pittsburgh: Global View Pub. 2007: 64. ISBN 0-9660813-9-0.
- ^ Karni, Miriam; Mandelbaum, Asher. The ‘even-electron rule’. Organic Mass Spectrometry. 1980, 15 (2): 53–64. ISSN 0030-493X. doi:10.1002/oms.1210150202.
- ^ Bright, J. W.; Chen, E. C. M. Mass spectral interpretation using the "rule of '13'". Journal of Chemical Education. 1983, 60 (7): 557. Bibcode:1983JChEd..60..557B. ISSN 0021-9584. doi:10.1021/ed060p557.
- ^ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 11.11 11.12 11.13 11.14 11.15 11.16 11.17 11.18 11.19 Dass, Chhabil. Fundamentals of contemporary mass spectrometry. Wiley-interscience. 2007: 219–232. ISBN 978-0-471-68229-5.
- ^ F. W. McLafferty. Mass Spectrometric Analysis. Molecular Rearrangements. Anal. Chem. 1959, 31 (1): 82–87. doi:10.1021/ac60145a015.
- ^ Gross ML. Focus in honor of Fred McLafferty, 2003 Distinguished Contribution awardee, for the discovery of the "McLafferty Rearrangement". J. Am. Soc. Mass Spectrom. 2004, 15 (7): 951–5. PMID 15234352. doi:10.1016/j.jasms.2004.05.009.
- ^ Nibbering NM. The McLafferty rearrangement: a personal recollection. J. Am. Soc. Mass Spectrom. 2004, 15 (7): 956–8. PMID 15234353. doi:10.1016/j.jasms.2004.04.025.
- ^ Kingston, David G. Intramolecular hydrogen transfer in mass spectra. II. The McLafferty rearrangement and related reactions.. Chemical Reviews. 1974, 74: 216–242. doi:10.1021/cr60288a004.
- ^ Holčapek, Michal; Jirásko, Robert; Lísa, Miroslav. Basic rules for the interpretation of atmospheric pressure ionization mass spectra of small molecules. Journal of Chromatography A. 2010, 1217 (25): 3908–3921. ISSN 0021-9673. PMID 20303090. doi:10.1016/j.chroma.2010.02.049.






