氯
氯(英語:Chlorine),是一種化學元素,化學符號为Cl,原子序數为17,属于鹵族(即周期系ⅦA族)。氯是第二輕的鹵素,处于氟和溴之間,因此氯的非金属性介于它们之间。氯在室溫下是一种有强烈刺激性气味的黃綠色有毒氣體,液化后变为黄色油状液体。它是反應性極強的元素和強氧化劑。氯的電子親和力在所有元素中最高,且是鲍林電負度中第三高电负性的元素,僅次於氧和氟。
從遠古時期,人們就知道一种含氯的化合物——氯化鈉(食用鹽的主要成分)。1630年,氯氣在一次偶然的实验中首次被合成出來,但並不被当时的人们認為是一种重要的物質。1774年,卡爾·威廉·舍勒寫了一篇關於氯氣的描述,推測它是新元素的氧化物。1809年,约瑟夫·路易·盖-吕萨克和路易·雅克·泰纳尔認為這种氣體是一种新的化学元素,而这个假设由英国化学家漢弗里·戴維在1810年证实。他以该种气体的颜色“淡绿色”(古希臘文:χλωρός、羅馬文:khlôros)为之命名。
因為氯很活泼,所以地殼中所有的氯皆以氯離子化合物的形式存在,例如食鹽。氯是含量第二多的鹵素(仅次于氟元素),也是地殼中含量排名第二十多的元素(0.031%)。但這些地殼中氯沉積物與海水中氯化物含量相比則相形見絀。
商業生產的氯是通过電解食鹽水而得。家用漂白剂、消毒劑以及工業用的一些化學試劑的開發乃是得利於氯的高氧化電位性質。氯廣泛運用于製造消費者產品,包括三分之二的有機化學品像是聚氯乙烯、許多塑膠製品的中間產物和其他沒有包含氯元素的終端產品。游泳池经常使用含氯化合物以維持水池乾淨和衛生。高濃度的氯元素對生物體來說是極度危險和有毒的,第一次世界大戰曾使用氯氣作為第一個化學戰劑。
各種生物都需要以氯離子形式存在的氯。其他形式的含氯化合物在生物體中則很少存在,人造的含氯化合物有些具有毒性、有些則無。高層大氣中以氯氟烃为代表的含氯有机分子是造成臭氧層耗損的元凶。嗜中性球把氯离子氧化成次氯酸鹽时会產生少量氯元素,其可作為生物體免疫對抗細菌的一部分。
历史
[编辑]最常见的氯化合物——氯化钠在古代就已知。考古学家发现的证据表明,早在公元前3000年,人类就已经开始使用岩盐,早在公元前6000年已经开始使用卤水。[4]它在食物中的重要性在古典时代是众所周知的,有时用作支付罗马将军和军事看守所服务的费用。
早期发现
[编辑]约 900年时,贾比尔和波斯医师兼炼金术士拉齐正在研究sal ammoniac(氯化铵),当它与Vitriol(各种金属硫酸盐的水合物)混合时,会产生氯化氢。[5]然而,在这些早期的氯化物实验中,气态产物似乎被丢弃了,在发现它可以用于化学用途之前,氯化氢可能已经被合成了很多次。[6]氯的一个重要的发展是拟贾比尔的发现。他把氯化铵和硝酸混合,得到一种可以溶解金的溶剂,也就是王水。[7]虽然王水是不稳定的混合物,会持续散发含有氯气的烟雾,但它们在之前一直被忽视。直到1630年,扬·巴普蒂斯塔·范·海尔蒙特才发现到它是一种气态物质。[8][note 1]
分离
[编辑]
氯于1774年首次由卡尔·威廉·舍勒研究。这个发现归功于他。[9][10]他通过MnO2(以软锰矿的形式)和HCl的反应生成氯气:[8]
舍勒观察到了氯气的一些性质:漂白石蕊,杀死昆虫,黄绿色,气味像王水。[11]他把氯气称为「脱燃素的盐酸气」,因为它是源于盐酸的气体。[10]他未能将氯确认为一种元素。[10]
当时认为酸中一定有氧,所以很多化学家,包括克劳德·贝托莱都认为舍勒的「脱燃素的盐酸气」肯定是氧和未知元素muriaticum的化合物。[12][13]
1809年,约瑟夫·路易·盖-吕萨克和路易·雅克·泰纳尔尝试分解「脱燃素的盐酸气」。他们把碳和「脱燃素的盐酸气」反应,试图得到muriaticum(和二氧化碳)。[10]他们没有成功并发表了一份报告,其中他们考虑了「脱燃素的盐酸气」是一种元素的可能性,但没有被说服。[14]
1810年,汉弗里·戴维重试了这个实验,并确认这种物质是一种元素,不是化合物。[10]同年11月15日,他向皇家学会宣布了他的结果。[8]当时,他把这种元素称为chlorine。这个词来源于希腊文χλωρος(chlōros),意为“黄绿色”,即氯气的颜色。[15]1823年,迈克尔·法拉第首次取得液氯。[16][17][18]
之后的用处
[编辑]1785年,克劳德·贝托莱发现氯气可以漂白布料。[19][20]现在的漂白剂都是贝托莱的进一步工作。1789年,他在自己位于雅弗尔(现在是巴黎的一部分)的实验室里,通过氯气通过碳酸钠溶液首次合成了次氯酸钠。反应得到的液体被称为“Eau de Javel”(雅弗尔水),为次氯酸钠的溶液。这个过程不是很有效,并且人们都在寻求替代生产方法。Charles Tennant首先生产了次氯酸钙(氯化石灰)溶液,然后是固体次氯酸钙(漂白粉)。[19]这些化合物产生的氯含量低,并且可以比次氯酸钠更有效地运输。它们仍为稀溶液,因为当经过提纯以消除水时,它会成为一种危险、强大且不稳定的氧化剂。在19世纪末,E. S. Smith 获得了一种次氯酸钠生产方法的专利。这个方法涉及电解卤水以生产氢氧化钠和氯气,然后混合形成次氯酸钠。[21]这被称为氯碱法,于1892年首次以工业规模引入,现在是大部分氯气和氢氧化钠的来源。[22]1884年,德国的Chemischen Fabrik Griesheim开发了另一种氯碱法,并于1888年进入商业生产。[23]
1820年代,早在疾病的细菌学说建立前,法国最初用溶于碱的氯溶液(次氯酸钠和次氯酸钙)来作为抗尸体腐败剂和消毒剂。这种做法是由Antoine-Germain Labarraque开创的,他改编了贝托莱的“雅弗尔水”漂白剂和其他氯的制备方法。[24]自那以后,氯元素在局部消毒(伤口冲洗液等)和公共卫生,尤其是游泳和饮用水方面持续发挥作用。[11]
在伊珀尔,氯气于1915年4月22日首次被德意志帝国陆军用作武器。[25][26]氯这个武器对盟友的影响是毁灭性的,因为当时的防毒面具难以部署,且没有广泛使用。[27][28]
名稱由來
[编辑]英文名稱chlorine來自於希臘文khlôros(χλωρóς',淡綠色)。19世纪70年代,中国化学家徐寿将其译为绿气。1933年,化学家郑贞文在《化学命名原则》中把这个字改为了“氯”。[29]在日文與韓文中,因為氯是鹽的主要成分之一而稱為「鹽素」(日本漢字現在寫作「塩素」)。
自然分布
[编辑]氯气的活性太高,不会在天然中存在。不过氯化物在自然界广泛存在。它是地壳第21多的元素,占了 126 ppm,大部分以氯化物矿物存在,尤其是从水体蒸发来的氯化钠。与海水中氯离子的储量相比,所有这些都相形见绌:高浓度的氯离子在一些内海和地下卤水井中,如犹他州的大盐湖和以色列的死海可以找到。[30]
自然界中游离状态的氯存在於大氣層中,是破壞臭氧層的单质之一。氯氣受紫外線分解成兩個氯原子(自由基)。
生产
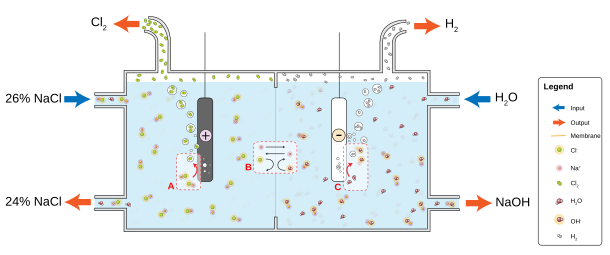
[编辑]实验室中可以通过盐酸和二氧化锰反应取得少量氯气,但由于这些氯气随时可用,因此很少出现这种需求。在工业上,氯通常是通过电解溶解在水中的氯化钠来生产的。这个方法被称为氯碱法,在 1892年工业化,现在是提供大部分工业氯气的方法。[22]这个反应也会生成氢气和氢氧化钠。这个反应如下:[31]
氯化物溶液的电解均按照以下方程式进行:
- 阴极:2 H2O + 2 e− → H2 + 2 OH−
- 阳极:2 Cl− → Cl2 + 2 e−
在隔膜电解槽电解中,石棉(或聚合物纤维)隔膜将阴极和阳极隔开,防止在阳极生成的氯与在阴极生成的氢氧化钠和氢重新混合。[32]盐水溶液被连续送入阳极室,并通过隔膜流到阴极室,在那里产生腐蚀性碱并耗掉部分盐水。隔膜法产生的碱是略为不纯的稀碱,但没有汞处理的问题,而且更节能。[22]
隔膜电解槽电解采用半透膜作为离子交换剂。饱和的氯化钠(或氯化钾)溶液通过阳极室,以较低的浓度离开。这种方法也能生产非常纯的氢氧化钠(或氢氧化钾),但缺点是需要高浓度的非常纯的盐水。[33]
在Deacon法中,氯化氢被氧气氧化,生成氯气:
- 4 HCl + O2 → 2 Cl2 + 2 H2O
该反应需要催化剂。正如Deacon介绍的那样,早期的催化剂是基于铜的。现在已转向使用铬基和钌基催化剂。[34]
性质
[编辑]

氯是鹵素的第二個元素,在元素週期表中為第17族,因此它的特性與氟、溴和碘很相似,它的大部分特性介於氟與溴之間。氯的電子軌域組態為[Ne]3s23p5,在第三以及最外層軌域的電子有七個,其表現為七個價電子,如同所有的鹵素,氯也比完整的八隅體少了一個電子,因此為很強的氧化劑,會與許多元素反應以使它的外層軌域變得完整。[35]對應於週期表的位置,氯的電負度介於氟與溴之間(氟:3.98、氯:3.16、溴:2.96、碘:2.66),活性比氟低,但比溴活躍,氯和氟相比為較弱的氧化劑,和溴相比則為較強的氧化劑。[35]因為氯的原子半徑介於氟與溴之間,因此氯的許多原子特性延續了碘至溴的趨勢,例如第一游離能、電子親和力、X2的分子解離焓(X為氯、溴、碘)、離子半徑以及X和X之間的鍵長度。(氟因為較小所以較為特異)。[35]
四個較穩定的鹵素皆受分子間凡得瓦爾力的吸引,且凡得瓦爾力的強度會隨著同核雙原子分子電子的數目而增加,因此氯的融點與沸點介於氟與溴之間,氯的融點為−101.0 °C且沸點為−34.0 °C,由於鹵素越往週期表下方分子量越高,氯的熔化熱和氣化熱也介於氟和溴之間,由于雙原子分子結構的原因,它們的氣化熱相當的低(造成較易揮發)。[35]鹵素一族越往下顏色越深,氟是淡黃色氣體,氯是明顯的黃綠色,會有這樣的趨勢是因為鹵素越往週期表下方所吸收的可見光波長增加所致。[35]當電子由最高佔有反鍵結πg分子軌域躍遷至最低反鍵結σu分子軌域時便會形成鹵素的顏色。[36]這些顏色會在較低溫下退色,因此在−195 °C固態的氯是幾近無色的。[35]
像固態的溴以及碘、固態的氯在斜方晶系的結晶為氯分子的層狀晶格,它的化學鍵距離是198 pm(相當接近氯氣化學鍵的距離199 pm)且在一層中氯分子與分子的距離為332 pm,而層與層之間的距離是382 pm(相較於氯的凡得瓦爾半徑為180 pm),這結構表示氯是很差的導電體,實際上氯的導電度也確實極低而無法測量。[35]
同位素
[编辑]氯有兩個穩定的同位素:氯-35和氯-37。這兩個同位素是氯在大自然中唯二存在的形式,其中氯-35佔了76%,而氯-37則佔了剩下的24%,這兩個同位素是由恆星經氧燃燒過程以及矽燃燒過程而形成[37]。雖然核自旋幅度大於1/2會造成非球型核電荷分布,以及共振變廣而造成非零值核四極矩與四極性遲緩,但兩個同位素皆有核自旋3/2+,因此可用在核磁共振光譜。其他氯的同位素皆具放射性,且半衰期極短而無法存在自然界中,因此,最常用於實驗室的是氯-36(半衰期為3×105年)和氯-38(半衰期為37.2分鐘),氯-36和氯-38可藉由自然界中氯的中子活化而製成。[35]
氯最穩定的放射性同位素為氯-36,比氯-35還輕的同位素主要的衰變模式是電子捕獲而變成硫的同位素,比氯-37還重的同位素會經衰變形成氬的同位素,而氯-36會衰變成穩定的硫-36或氬-36。[38]作為宇宙源放射性同位素核種,氯-36存在於自然界的量與穩定的氯同位素相比,比例約為7× 10−13–1×10−12比1。它是由氬-36接觸宇宙射線中的質子作用後散裂於大氣中而產生。在岩石圈的頂部,氯-36主要是透過氯-35的熱中子活化以及鉀-39和鈣-40的散裂所產生。在地底下的環境,鈣-40會抓住緲子而產生氯-36,此種方式對於產生氯-36變得越來越重要。[39][40]
化学性质
[编辑]| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
氯的反应性在氟和溴之间,也是反应性最高的元素之一。氯的氧化性比氟弱,但比溴和碘强。这可以从卤素X2/X−的标准电极电势中观察到(F +2.866 V、Cl +1.395 V、Br +1.087 V、I +0.615 V、At约为+0.3 V)。不过,这个趋势不存在于卤素单质的X-X键键强,因为氟原子很小、低极化性、也不能形成超价分子。作为比较,氯的正氧化态很常见,而氟不是这样的。氯化可以得到比溴化和碘化更高的氧化态,但这比氟化得到的氧化态低。氯可以和含有M–M、M–H、M–C键的物质反应,形成M–Cl键。[36]
由于𝐸ᶱ (1/2O2/H2O) = +1.229 V,小于氯的 +1.395 V,因此氯被认为可以氧化水,形成盐酸和氧气。但是,这个反应在动力学不利,且需要考虑气泡过电位的效应。因此,氯化物水溶液的电解会产生氯气而不是氧气,对氯气的工业生产非常有用。[41]
化合物
[编辑]氯可以形成多种无机化合物,如氯化物、次氯酸盐、亚氯酸盐、氯酸盐、高氯酸盐等,也能形成众多有机化合物,有机氯化合物包括各种氯代烃(如三氯甲烷、氯苯等)、羧酸衍生物酰氯等。
氯化氢
[编辑]
最简单的氯化合物是氯化氢,化学式 HCl, 是工业和实验室中的主要化学品,常温下为气体,溶于水形成盐酸。它可以由氢气在氯气里燃烧而成,也是氯化碳氢化合物产生的副产物。另外一种制备盐酸的方法是氯化氢和浓硫酸反应:[42]
- NaCl + H2SO4 NaHSO4 + HCl
- NaCl + NaHSO4 Na2SO4 + HCl
在实验室里,氯化氢可以由浓硫酸对盐酸脱水而成。氯化氘,化学式 DCl,可以由苯酰氯和重水 (D2O)反应而成。[42]
和除了氟化氢以外的卤化氢一样,常温下的氯化氢是一种无色气体。氯化氢是气体的原因是氢不能和较大的氯原子形成氢键。不过,低温下的氯化氢晶体里有弱氢键。这类似于氟化氢的结构,在温度升高时开始出现无序。[42]盐酸是强酸(pKa = −7),这是由于氢键太弱,防止不了解离而成的。HCl/H2O 系统里有很多 HCl·nH2O 水合物,其中n = 1, 2, 3, 4和 6。在氯化氢和水的 1:1 混合物之后,该系统完全分离成两个独立的液相。盐酸会形成一种共沸物,沸点 108.58 °C,在100g 溶液里有 20.22 g HCl。比这个更浓的盐酸不能通过蒸馏制备。[43]
不像无水氟化氢,无水氯化氢难以作为溶剂,因为它的沸点低,液态范围小,相对电容率低,不会自偶电离成H2Cl+和HCl−
2离子。后者类似于氟化氢根离子(HF−
2),其中氢与氯之间有极弱的氢键,对应的Cs+和NR+
4(R = Me、Et、Bun)盐可分离。无水氯化氢是一种弱溶剂,只能溶解像是亚硝酰氯和苯酚这样的小分子,或是晶格能极低的四烷基卤化铵。它可以质子化含有孤对电子或π键的亲电体。和溶剂反应、配体互换反应和氧化反应在氯化氢溶液中广泛存在:[44]
- Ph3SnCl + HCl ⟶ Ph2SnCl2 + PhH(和溶剂反应)
- Ph3COH + 3 HCl ⟶ Ph
3C+
HCl−
2 + H3O+Cl−(和溶剂反应) - Me
4N+
HCl−
2 + BCl3 ⟶ Me
4N+
BCl−
4 + HCl(配体互换) - PCl3 + Cl2 + HCl ⟶ PCl+
4HCl−
2(氧化)
其它二元氯化物
[编辑]
几乎所有元素都可以形成二元氯化物。不能形成二元氯化物的原因有三个:极度惰性,难以参与化学反应(例如惰性气体,会形成极不稳定的XeCl2 和 XeCl4 的氙除外);放射性极强,会在反应前衰变(大部分铋后元素);以及电负性比氯大(氧和氟),这时形成的化合物不叫氯化物,而是氧化物或氟化物。[45]
在有可变氧化态的金属中,使用Cl2氯化金属会比使用Br2溴化金属得到的氧化态高。举个例子:钼分别被氯和溴卤化会分别得到MoCl5 和MoBr3。氯化物也可以由元素单质或它的氧化物、氢氧化物和碳酸盐和盐酸反应而成,然后在中高温下,通过低压或无水氯化氢气体结合来脱水。制备低氧化态氯化物可以由氢气或金属还原高价氯化物而成。它们也可以通过歧化反应或分解产生:[45]
- EuCl3 + 1/2 H2 ⟶ EuCl2 + HCl
- ReCl5 ReCl3 + Cl2
- AuCl3 AuCl + Cl2
大部分碱金属、碱土金属和3族元素,还有处于+2和+3氧化态的镧系元素和锕系元素形成的氯化物是离子型的,而非金属还有氧化态大于+3的金属会形成共价分子型氯化物。氯化银不溶于水,可以用来检测氯离子。[45]
多氯化合物
[编辑]虽然氯气是一种强氧化剂,有很高的电离能,在极端条件下它也可以被电离成 Cl+
2 阳离子。它非常不稳定,只有在低压放电管中产生时才具有其电子带谱的特征。黄色的 Cl+
3 阳离子比较稳定,可以通过下面的方法产生:[46]
- Cl2 + ClF + AsF5 Cl+
3AsF−
6
该反应在氧化性溶剂五氟化砷中进行。三氯阴离子,化学式 Cl−
3也是已知的,结构类似三碘阴离子。[47]
氯的氟化物
[编辑]氯有三种氟化物,都是反磁性的互卤化物。[47]一些离子衍生物也是已知的,例如 ClF−
2、ClF−
4、ClF+
2和 Cl2F+。[48]
一氟化氯(ClF)在热力学稳定,可以以 500克钢瓶的形式商购。它是一种无色气体,熔点 −155.6 °C,沸点 −100.1 °C。它可以由氟和氯在 225 °C下直接反应而成,需要和三氟化氯和反应物分离。它的性质大多介于氟和氯之间。它会氟化很多金属和非金属,并放出氯。它也是一种氟氯化试剂,会把一氧化碳氟氯化成碳酰氟氯(化学式 COFCl),在氟化钾催化下和六氟丙酮(化学式 (CF3)2CO)反应成次氯酸七氟异丙酯,化学式 (CF3)2CFOCl。一氟化氯也会和腈 RCN 反应,形成 RCF2NCl2。它也和硫氧化物SO2和SO3反应,分别形成ClSO2F和ClOSO2F。它会和含有–OH 和–NH 基团的物质(像是水和氨)激烈反应。[47]
- H2O + 2 ClF ⟶ 2 HF + Cl2O
三氟化氯(ClF3)是挥发性的无色液体,熔点−76.3 °C ,沸点11.8 °C。它可以由氟气和一氟化氯在200–300 °C下反应而成。它是已知最活泼的物质之一,会与许多在通常情况下被认为具有化学惰性的物质发生反应,像是石棉、混凝土和沙。它会和很多有机物和水反应,发生爆炸。它可以点燃很多元素,包括氢、钾、磷、砷、锑、硫、硒、碲、溴、碘,还有粉末状的钼、钨、铑、铱、铁。它和钠、镁、铝、锌、锡、银反应会形成不透水的氟化物层,可以通过加热去除。当加热时,钯、铂、金等抗腐蚀金属都会与它反应,连惰性气体氙和氡都逃脱不了氟化。镍容器通常用来储存三氟化氯,因为它会形成活性低的氟化镍保护层。它和肼反应,形成氟化氢、氯气和氮气,可用于实验火箭发动机,但问题主要源于其极端的燃料自燃性,导致点火没有任何可测量的延迟。今天,三氟化氯主要用于核燃料,把铀氟化成六氟化铀来得到浓缩铀和分离钚。它也是一种氟离子供体或受体,虽然它不会电离成 ClF+
2 和ClF−
4 离子。[49]
五氟化氯(ClF5)可以由氯和大量氟气在350 °C和250个大气压下反应而成。它的熔点为−103 °C,沸点为−13.1 °C。它是非常强的氟化剂,但比三氟化氯弱。它和五氟化砷和五氟化锑反应,形成离子型加合物[ClF4]+[MF6]−(M = As, Sb)。五氟化氯与水剧烈反应:[50]
- 2 H2O + ClF5 ⟶ 4 HF + FClO2
产物氯酰氟是五种已知的氟氧化氯之一,其它四种分别是热力学不稳定的FClO、活性不太高的高氯酰氟FClO3、F3ClO和F3ClO2。它们的性质类似于氯的氟化物,也是非常强的氧化剂和氟化剂。[51]
氯的氧化物
[编辑]

氯的氧化物尽管不稳定(它们都是吸热化合物),但已得到充分研究。它们很重要,因为它们是在氯氟烃在高层大气中进行光解并导致臭氧层破坏时产生的。 它们都不能由氯和氧直接反应而成。[52]
一氧化二氯 (Cl2O) 是一种棕黄色气体,可以由氯气和黄色的氧化汞反应而成。它易溶于水,会和次氯酸 (HOCl)形成平衡。它是一种有效的漂白剂,可以制备次氯酸盐。它在加热、火花或存在氨气时爆炸。[52]
二氧化氯 (ClO2) 是第一种被发现的氯的氧化物,于 1811年由汉弗里·戴维发现。它是一种顺磁性的黄色液体,有奇数颗电子。由于未配对电子的离域,它不会二聚。它在 −40 °C 以上爆炸,因此用于木浆漂白和水处理的二氧化氯必须是低浓度的。它通常以还原氯酸盐的方法制备:[52]
- ClO−
3 + Cl− + 2 H+ ⟶ ClO2 + 1/2 Cl2 + H2O
因此,其生产与氯含氧酸的氧化还原反应密切相关。它是一种强氧化剂,会和硫、磷、卤化磷和硼氢化钾反应。它在水中放热溶解,形成深绿色溶液,在黑暗中非常缓慢地分解。不过在光照下,这个溶液会迅速分解成盐酸和氯酸。单独的ClO2分子的光解会产生ClO和ClOO自由基,在室温下会产生氯、氧,还有一些ClO3和Cl2O6。Cl2O3可以通过在−78 °C光解二氧化氯固体而成。它是一种深棕色固体,在0 °C以下爆炸。ClO自由基可通过以下反应,破坏大气中的臭氧:[52]
- Cl• + O3 ⟶ ClO• + O2
- ClO• + O• ⟶ Cl• + O2
高氯酸氯 (ClOClO3) 是一种浅黄色液体,稳定性比 ClO2低,在室温下分解成氯、氧和六氧化二氯 (Cl2O6)。[52]高氯酸氯可以看作是高氯酸 (HOClO3)的氯衍生物,类似于其它含氧酸不稳定的氯衍生物如:硝酸氯(ClONO2,高反应性和爆炸性)和氟磺酸氯(ClOSO2F,比较稳定,不过还是高反应性和易水解)。[53]六氧化二氯是一种深红色液体,在 −180 °C下为黄色固体。它可以由二氧化氯和氧气反应而成。比起是 ClO3的二聚体,它的结构更像是 [ClO2]+[ClO4]−。它水解成氯酸和高氯酸,而与氟化氢的反应不完全。[52]
七氧化二氯(Cl2O7)是高氯酸(HClO4)的酸酐,可以由磷酸在−10 °C 下对高氯酸进行脱水,并在 −35 °C 和1 mmHg下蒸馏而成。它是一种对冲击敏感的无色油状液体。它是氯的氧化物中反应性最低的,也是唯一一种不会让有机物在室温下着火的氯的氧化物。它可溶于水,形成高氯酸或溶于碱水溶液,形成高氯酸盐。不过,通过弄断其中一个中心Cl–O键,七氧化二氯会爆炸性热分解成 ClO3和ClO4自由基,然后迅速分解成氯气和氧气。[52]
氯含氧酸和含氧酸盐
[编辑]氯有四种含氧酸,分别是次氯酸(HOCl)、亚氯酸(HOClO)、氯酸(HOClO2)、高氯酸(HOClO3)
大多数氯的含氧酸可以通过歧化反应来生产。次氯酸 (HOCl) 具有高反应性且非常不稳定,它的盐——次氯酸盐主要用于漂白和杀菌。它们都是很强的氧化剂,会向无机分子放出一个氧原子。亚氯酸 (HOClO)更不稳定,不能在不分解的情况下分离或浓缩,从二氧化氯水溶液的分解中可知。不过,亚氯酸钠是一种稳定的盐,可用于漂白和剥离纺织品,也是一种氧化剂和二氧化氯的前体。氯酸 (HOClO2)是一种强酸,30% 浓度的氯酸在冷水稳定,但加热时会分解成氯和二氧化氯。减压蒸发可以使氯酸进一步浓缩至约 40%,但随后分解为高氯酸、氯气、氧气、水和二氧化氯。最重要的氯酸盐是氯酸钠,多用于制造二氧化氯以漂白纸浆。实验室里,从氯酸盐分解成氯化物和氧气的反应可以用来得到少量的氧气。氯化物和氯酸盐可以归中产生氯气:[54]
- ClO−
3 + 5 Cl− + 6 H+ ⟶ 3 Cl2 + 3 H2O
高氯酸盐和高氯酸 (HOClO3) 是氯最稳定的含氧化合物。高氯酸和高氯酸盐的水溶液在加热时是强氧化剂,这与它们在室温下大多不活泼的性质形成鲜明对比,因为这些反应出于动力学原因具有高活化能。高氯酸盐是通过氧化电解氯酸钠制成的,而高氯酸可以由高氯酸钠或高氯酸钡和浓盐酸反应,然后滤去沉淀的氯化物。无水高氯酸是一种无色可流动液体,对震动敏感,与大多数有机化合物接触会爆炸,使碘化氢和亚硫酰氯着火,甚至氧化银和金。虽然高氯酸根是一种很弱的配体,比水还弱,但一些含有ClO−
4 配体的物质是已知的。[54]
有机氯化合物
[编辑]
类似其它碳-卤键, C–Cl 键是一种常见的键,组成了有机化学核心的一部分。具有该官能团的化合物可视为氯离子的有机衍生物。由于氯 (3.16) 和碳 (2.55) 之间的电负性不同,C-Cl 键中的碳是缺电子的,因此有亲电性。氯化以多种方式改变碳氢化合物的物理性质:有机氯化合物通常比水重,这是由于氯的原子量大导致的。此外,脂肪族有机氯化合物是烷基化试剂,因为氯是一种离去基团。[55]
烷烃和芳烃可以在自由基下(紫外线照射)被氯化。然而,氯化程度难以控制:该反应不是区域选择性的,并且经常合成具有不同氯化程度的各种异构体的混合物。如果产物容易分离,这可能是被允许的。氯代芳烃可以由和氯气的傅-克反应制备而成,催化剂为路易斯酸。[55]卤仿反应使用氯和氢氧化钠,也能够从甲基酮和相关化合物中生成卤代烷。氯可以加成到双键或三键上,形成二氯化物和四氯化物。然而,由于氯的费用和反应性,有机氯化合物更常使用氯化氢,或是其它氯化剂,像是五氯化磷 (PCl5) 和氯化亚砜 (SOCl2)。使用氯化亚砜在实验室中非常方便,因为反应中所有副产物都是气态的,不必蒸馏出来。[55]
许多有机氯化合物已从从细菌到人类的天然来源中分离出来。[56][57]有机氯化合物几乎存在于每一类生物分子中,包括生物碱、萜烯、氨基酸、黄酮类化合物、类固醇和脂肪酸。[56][58]包括二恶英在内的有机氯化合物是在森林火灾的高温环境中产生的,并且在比合成二恶英更早发生的闪电燃烧的灰烬中发现了二恶英。[59]此外,人们已从海藻中分离出多种简单的氯代烃,包括二氯甲烷、氯仿和四氯化碳。[60]环境中的大部分氯甲烷是由生物分解、森林火灾和火山自然产生的。[61]
一些有机氯化合物对动植物,包括人类都有毒。二恶英是有机物在氯存在下燃烧时产生的,而一些杀虫剂(如DDT)是持久性有机污染物,当它们释放到环境中时会造成危险。举个例子,在 20 世纪中叶被广泛用于控制昆虫的 DDT也在食物链中积累,并导致某些鸟类的繁殖问题(例如蛋壳变薄)。[62]由于氯氟烃的 C-Cl 键易于均裂,在高层大气中会产生氯自由基,破坏臭氧层。因此,它已被淘汰。[52]
用途
[编辑]氯可以作为一种較便宜的消毒劑,一般的自来水及游泳池就常采用它来消毒。但由於氯氣的水溶性較差、毒性較大、會放出特殊氣味,且容易产生有致癌風險的三鹵甲烷等有机氯化合物,故中國、美國等國常改用二氧化氯(ClO2)、氯胺或臭氧等代替氯氣作為水的消毒劑。
除了用於消毒,氯氣也是一种重要的化工原料,用於制造盐酸和漂白粉、制造氯代烃。也可以用于制造多种农药、制造氯仿等有机溶剂。此外氯氣還广泛用于造纸、纺织、有机合成、金属冶炼等行业,也有作為化學武器的紀錄:氯氣彈在1915年由德国陆军首次在军事用途上使用,对比利时境内伊普雷的英法联军,使用此武器,造成重大伤亡及战果。
氯化钠是最常见的氯化合物,是化学工业所需氯的主要来源。大约有 15000 种氯化合物可进行商业交易,包括氯代甲烷、氯代乙烷、氯乙烯、聚氯乙烯 (PVC)、三氯化铝等多种化合物。镁、钛、锆和铪的氯化物是取得这些元素单质的中间体。[11]
在生产的所有氯单质中,约 63% 用于制造有机化合物,18% 用于制造无机氯化合物。[63]商业上使用了大约 15000 种氯化合物。[64]剩下 19% 的氯则用于漂白剂和消毒产品。[65]以产量计,最重要的有机氯化合物是1,2-二氯乙烷和氯乙烯,它们都是生产 PVC的中间体。其它重要的有机氯化合物包括氯甲烷、二氯甲烷、氯仿、1,1-二氯乙烯、三氯乙烯、四氯乙烯、烯丙基氯、环氧氯丙烷、氯苯、二氯苯和三氯苯。主要的无机氯化合物包括 HCl、HClO、NaClO3、AlCl3、SiCl4、SnCl4、PCl3、PCl5、POCl3、AsCl3、SbCl3、SbCl5、BiCl3、S2Cl2、SCl2、SOCl2、ClF3、ICl、ICl3、TiCl3、TiCl4、MoCl5、FeCl3和ZnCl2等等。[65]
卫生、消毒和防腐
[编辑]对抗腐败
[编辑]在法国(和其他地方一样),动物的肠可被加工制成乐器的弦、Goldbeater的皮肤等产品。这是在“肠道工厂”中完成的,是一个很臭和不健康的过程。大约在 1820 年左右,民族工业激励协会会对发现一种化学或机械方法来分离动物肠道 的腹膜而不会导致尸体腐败的人给出奖赏。[66][67]这个奖赏是由安托万-日耳曼·拉巴拉克,一个 44岁的法国化学家和药剂师得到的。他发现贝托莱的“雅弗尔水”不仅破坏了动物组织分解的腐烂气味,而且还延缓了分解。[67][24]
拉巴拉克的研究导致“肠道工厂”使用氯化物、次氯酸钙和次氯酸钠。人们还发现这些化学品可用于厕所、下水道、市场、屠宰场、解剖剧院和太平间的常规消毒和除臭。[68]这些化合物还在医院、检疫站、监牢、丝仓、马厩、牛棚等方面取得了成功。它们也在埋葬、[69]防腐、流行病爆发、发烧和牛的黑脚病中有益。[66]
公共卫生
[编辑]
1908 年,新泽西州泽西市首次在美国饮用水中应用氯化法。[70]到了 1918 年,美国财政部呼吁对所有饮用水进行氯消毒。 氯是目前用于水净化(例如在水处理厂)、消毒剂和漂白剂中的重要化学品。 现在,即使是小水源也经常被氯化。[71]
氯通常以次氯酸的形式杀死饮用水供应和公共游泳池中的细菌和其他微生物。在大多数私人游泳池中,不会使用氯本身,而是使用次氯酸钠,由氯和 氢氧化钠反应而成,或是氯化三聚氰酸盐的固体片剂形成。在游泳池中使用氯的缺点是氯会与人类头发和皮肤中的蛋白质发生反应。与普遍的看法相反,游泳池里独特“氯气味”不是元素氯本身造成的,而是一氯胺,一种由游离溶解氯与有机物质中的胺反应产生的化合物造成的。作为水中的消毒剂,氯的对大肠杆菌的作用是溴的三倍以上,碘的六倍以上。[72]越来越多的一氯胺被直接添加到饮用水中以进行消毒,这一过程被称为氯胺化。[73]
储存和使用有毒的氯气来进行水处理通常是不切实际的,因此需要使用添加氯的替代方法。这些方法包括使用会在水中放出氯气的次氯酸盐溶液,二氯异氰尿酸钠(二水或无水)和1,3,5-三氯-1,3,5-三嗪-2,4,6-三酮。这些化合物在固态时是稳定的,可以以粉末、颗粒或片剂形式使用。当少量的这些化合物被添加到池水或工业用水系统中时,氯原子会从分子的其余部分水解,形成次氯酸 (HClO),可作为一般的杀生物剂,杀死细菌、微生物、藻类等。[74][75]
用作武器
[编辑]第一次世界大战
[编辑]第一次世界大战的第二次伊珀尔战役期间,氯气于1915年4月22日首次被德意志帝国陆军用作武器[76][77]正如士兵们所描述的,它有一种胡椒和凤梨混合的独特气味,也尝到了金属味,刺痛了喉咙和胸部的后部。氯会和肺粘膜中的水反应,形成盐酸, 对活组织具有破坏性并可能致命。防毒面具和活性炭或其他过滤器可以保护人体呼吸系统免受氯气的侵害,这使得氯气的致命性远低于其他化学武器。它是由德国科学家弗里茨·哈伯与法本公司合作开发的,后者开发了排放氯气的方法来对付壕溝里的敌人。[78]首次使用后,双方都使用氯作为化学武器,但很快就被更致命的光气和芥子气所取代。[79]
伊拉克
[编辑]2007年,氯气也被用于安巴尔省的伊拉克战争,叛乱分子用迫击炮和氯气罐包装汽车炸弹。这次袭击造成两人死亡,超过 350 人患病。其中,大多数死亡是由爆炸的威力造成的,而不是氯的影响,因为有毒气体很容易随着爆炸在大气中分散和稀释。在一些爆炸事件中,一百多名平民因呼吸困难而住院。伊拉克当局加强了氯元素的保卫,这对于向民众提供安全饮用水至关重要。[80][81]
据报道,2014年10月23日,伊斯兰国曾在伊拉克的Duluiyah镇使用过氯气。[82]对衣服和土壤样本的实验室分析证实,2015年1月23日,有人在摩苏尔附近的47号公路 Kiske 路口,对库尔德佩什梅格部队使用了氯气。[83]
叙利亚
[编辑]叙利亚政府将氯用作化学武器[84],由桶装炸弹和火箭发射。[85][86]2016年,禁止化武组织-联合国联合调查机制得出的结论是叙利亚政府在三起单独的袭击中使用氯作为化学武器。[87]禁化武组织调查和鉴定小组后来的调查得出结论,叙利亚阿拉伯空军应对 2017 年和 2018 年的氯气袭击负责。[88]
对人体的影响
[编辑]氯是人体所必需的常量元素之一。其作用有调节细胞外液的容量与渗透压、维持酸碱平衡、参与血液CO2运输等。[89]氯離子為代謝作用很重要的物質,胃中鹽酸的生成和細胞幫浦的功能皆需要氯。[90]飲食中主要的來源是餐桌上的鹽或氯化鈉,血液中過低或高濃度的氯為電解質失調的實例,在沒有其他異常的情況下很少發生低氯血症,它有時與換氣不足有關。[91]它可能與長期呼吸酸中毒有關。[92]高氯血症(太多的氯)通常沒有症狀,當有症狀也與高血鈉症很像(太多鈉),血中氯含量的減少會導致腦缺水,症狀通常起因於快速復水後的腦水腫,高氯血症會影響氧氣的運輸。[93]
| 单位:毫克每日 | 中国[89] | 美国[94] |
|---|---|---|
| 适宜摄入量
(adequate intake;AI) |
2300 | 2300 |
| 可耐受最高摄入量
(tolerable upper intake level;UL) |
不详 | 3600 |
危险性
[编辑]| 氯 | |
|---|---|

| |
| 危险性 | |
GHS危险性符号  
| |
| GHS提示词 | Danger |
| H-术语 | H270, H315, H319, H331, H335, H400 |
| P-术语 | P220, P244, P261, P304, P340, P312, P403, P233, P410, P403[95] |
| NFPA 704 | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氯是一种有毒的气体,会攻击呼吸系统、眼睛和皮肤。[96]它比空气密度大,所以它往往会积聚在通风不良的空间底部。氯是一种强氧化剂,可能与易燃材料发生反应。[97][98]
通过测量仪器可以检测到 0.2 ppm 的氯气,在 3 ppm时可以嗅到。在 30 ppm 的氯气下会造成咳嗽和呕吐,在 60 ppm下会损害肺部。1000 ppm(0.1%)的氯气在几次呼吸中就可以造成生命危险。[11]氯气的立刻对生命和健康造成危险值为 10 ppm。[99] 呼吸低浓度氯气会加重呼吸系统的负担,暴露在氯气中会刺激眼睛。[100] 氯的危害来自于其强氧化性。当氯气的浓度在 30 ppm以上时,它会和水或体液反应,形成盐酸 (HCl) 和次氯酸 (HClO)。
当用于水消毒时,氯与水的反应不是人类健康的主要问题。 水中存在的其他物质可能会产生消毒副产物,这些副产物会对人类健康产生负面影响。[101][102]
在美国,职业安全与健康管理局 (OSHA) 把氯气的允许接触限值定在 1 ppm,或是 3 mg/m3。美国国家职业安全卫生研究所则把推荐接触限值定在 0.5 ppm (暴露超过15 分钟)。[99]
在家里,当次氯酸盐漂白溶液与某些酸性排水管清洁剂接触产生氯气时,就会发生事故。[103]次氯酸盐漂白剂(一种洗衣添加剂)和氨(另一种洗衣添加剂)反应会产生氯胺类,另一类有毒化学品。[104]
氯导致的材料开裂
[编辑]氯广泛用于净化水,特别是饮用水和游泳池用水。 由于氯引起的不锈钢吊杆应力腐蚀开裂,游泳池天花板发生了几次灾难性的倒塌。[105]一些聚合物也对攻击敏感,包括聚甲醛和聚丁烯。这两种材料都用于冷热水家用管道,而应力腐蚀开裂在 1980 年代和 1990 年代在美国引起了广泛的故障。[106]
氯-铁火
[编辑]铁会和氯在高温下反应。这是一个强放热反应,会产生氯-铁火。[107][108] 氯-铁火在化工厂中是一种风险,其中大部分输送氯气的管道是由钢制成的。[107][108]
参见
[编辑]註釋
[编辑]- ^ van Helmont, Joannis Baptistae. Opera omnia [All Works]. Frankfurt-am-Main, (Germany): Johann Just Erythropel. 1682 [2021-06-13]. (原始内容存档于2021-12-18) (拉丁语). From "Complexionum atque mistionum elementalium figmentum." (Formation of combinations and of mixtures of elements), §37, p. 105: (页面存档备份,存于互联网档案馆) "Accipe salis petrae, vitrioli, & alumnis partes aequas: exsiccato singula, & connexis simul, distilla aquam. Quae nil aliud est, quam merum sal volatile. Hujus accipe uncias quatuor, salis armeniaci unciam junge, in forti vitro, alembico, per caementum (ex cera, colophonia, & vitri pulverre) calidissime affusum, firmato; mox, etiam in frigore, Gas excitatur, & vas, utut forte, dissilit cum fragore." (Take equal parts of saltpeter [i.e., sodium nitrate], vitriol [i.e., concentrated sulfuric acid], and alum: dry each and combine simultaneously; distill off the water [i.e., liquid]. That [distillate] is nothing else than pure volatile salt [i.e., spirit of nitre, nitric acid]. Take four ounces of this [viz, nitric acid], add one ounce of Armenian salt [i.e., ammonium chloride], [place it] in a strong glass alembic sealed by cement ([made] from wax, rosin, and powdered glass) [that has been] poured very hot; soon, even in the cold, gas is stimulated, and the vessel, however strong, bursts into fragments.) From "De Flatibus" (On gases), p. 408 (页面存档备份,存于互联网档案馆): "Sal armeniacus enim, & aqua chrysulca, quae singula per se distillari, possunt, & pati calorem: sin autem jungantur, & intepescant, non possunt non, quin statim in Gas sylvestre, sive incoercibilem flatum transmutentur." (Truly Armenian salt [i.e., ammonium chloride] and nitric acid, each of which can be distilled by itself, and submitted to heat; but if, on the other hand, they be combined and become warm, they cannot but be changed immediately into carbon dioxide [note: van Helmont’s identification of the gas is mistaken] or an incondensable gas.)
See also:- Helmont, Johannes (Joan) Baptista Van, Encyclopedia.Com (页面存档备份,存于互联网档案馆): "Others were chlorine gas from the reaction of nitric acid and sal ammoniac; … "
- Wisniak, Jaime (2009) "Carl Wilhelm Scheele," Revista CENIC Ciencias Químicas, 40 (3): 165–173 ; see p. 168: "Early in the seventeenth century Johannes Baptiste van Helmont (1579-1644) mentioned that when sal marin (sodium chloride) or sal ammoniacus and aqua chrysulca (nitric acid) were mixed together, a flatus incoercible (non-condensable gas) was evolved."
參考文獻
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Chlorine (页面存档备份,存于互联网档案馆), Gas Encyclopaedia, Air Liquide
- ^ Magnetic susceptibility of the elements and inorganic compounds (页面存档备份,存于互联网档案馆), in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ The earliest salt production in the world: an early Neolithic exploitation in Poiana Slatinei-Lunca, Romania. [2008-07-10]. (原始内容存档于April 30, 2011).
- ^ Kraus, Paul. Jâbir ibn Hayyân: Contribution à l'histoire des idées scientifiques dans l'Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque. Cairo: Institut Français d'Archéologie Orientale. 1942–1943. ISBN 9783487091150. OCLC 468740510. vol. II, pp. 41–42; Multhauf, Robert P. The Origins of Chemistry. London: Oldbourne. 1966. pp. 141-142.
- ^ Multhauf 1966,p. 142, note 79.
- ^ Karpenko, Vladimír; Norris, John A. Vitriol in the History of Chemistry. Chemické listy. 2002, 96 (12): 997–1005 [2021-06-13]. (原始内容存档于2021-12-18). p. 1002.
- ^ 8.0 8.1 8.2 Greenwood and Earnshaw, p. 789–92
- ^ Scheele, Carl Wilhelm. Om Brunsten, eller Magnesia, och dess Egenskaper [On braunstein [i.e., pyrolusite, manganese dioxide], or magnesia, and its properties]. Kongliga Vetenskaps Academiens Handlingar [Proceedings of the Royal Scientific Academy]. 1774, 35: 89–116, 177–194 [2021-06-13]. (原始内容存档于2020-04-23) (瑞典语). In section 6 on pp. 93–94 of his paper (页面存档备份,存于互联网档案馆), Scheele described how chlorine was produced when a mixture of hydrochloric acid and manganese dioxide (Brunsten) was heated: "6) (a) På 1/2 uns fint rifven Brunsten slogs 1 uns ren Spiritus salis. … samt lukten fo̊rsvunnen." ( 6) (a) On one half ounce of finely ground Braunstein [pyrolusite] was poured one ounce of pure spiritus salis [spirit of salt, hydrogen chloride]. After this mixture had been standing in the cold for one hour, the acid had assumed a dark brown colour. One part of this solution was poured into a glass, which was placed over the fire. The solution gave off an odour like warm aqua regia and after one quarter’s hour duration, it was as clear and colourless as water, and the smell had disappeared.) For an English translation of the relevant passages of this article, see: The Early History of Chlorine : Papers by Carl Wilhelm Scheele (1774), C. L. Berthollet (1785), Guyton de Morveau (1787), J. L. Gay-Lussac and L. J. Thenard (1809) (Edinburgh, Scotland: Alembic Club, 1912), pp. 5–10. (页面存档备份,存于互联网档案馆)
- ^ 10.0 10.1 10.2 10.3 10.4 17 Chlorine. Elements.vanderkrogt.net. [2008-09-12]. (原始内容存档于2010-01-23).
- ^ 11.0 11.1 11.2 11.3 Greenwood and Earnshaw, pp. 792–93
- ^ Ihde, Aaron John. The development of modern chemistry. Courier Dover Publications. 1984: 158 [2021-06-13]. ISBN 978-0-486-64235-2. (原始内容存档于2020-05-30).
- ^ Weeks, Mary Elvira. The discovery of the elements. XVII. The halogen family. Journal of Chemical Education. 1932, 9 (11): 1915. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- ^ Gay-Lussac; Thenard. Extrait des mémoires lus à l'Institut national, depuis le 7 mars 1808 jusqu'au 27 février 1809. [Extracts from memoirs read at the national Institute, from 7 March 1808 to 27 February 1809]. Mémoires de Physique et de Chimie de la Société d'Arcueil. 1809, 2: 295–358 [2021-06-13]. (原始内容存档于2014-02-12). See: § De la nature et des propriétés de l'acide muriatique et de l'acide muriatique oxigéné (On the nature and properties of muriatic acid and of oxidized muriatic acid), pp. 339–358. From pp. 357–358: "Le gaz muriatique oxigéné n'est pas, en effect, décomposé … comme un corps composé." ("In fact, oxygenated muriatic acid is not decomposed by charcoal, and it might be supposed, from this fact and those that are communicated in this Memoir, that this gas is a simple body. The phenomena that it presents can be explained well enough on this hypothesis; we shall not seek to defend it, however, as it appears to us that they are still better explained by regarding oxygenated muriatic acid as a compound body.") For a full English translation of this section, see: Joseph Louis Gay-Lussac and Louis Jacques Thénard, "On the nature and the properties of muriatic acid and of oxygenated muriatic acid" (Lemoyne College, Syracuse, New York, USA) (页面存档备份,存于互联网档案馆)
- ^ Davy, Humphry. The Bakerian Lecture. On some of the combinations of oxymuriatic gas and oxygene, and on the chemical relations of these principles, to inflammable bodies. Philosophical Transactions of the Royal Society of London. 1811, 101: 1–35 [2021-06-13]. Bibcode:1811RSPT..101....1D. doi:10.1098/rstl.1811.0001
 . (原始内容存档于2020-04-23). Davy named chlorine on p. 32: (页面存档备份,存于互联网档案馆) "After consulting some of the most eminent chemical philosophers in this country, it has been judged most proper to suggest a name founded upon one of its obvious and characteristic properties — its colour, and to call it Chlorine, or Chloric gas.* *From χλωρος."
. (原始内容存档于2020-04-23). Davy named chlorine on p. 32: (页面存档备份,存于互联网档案馆) "After consulting some of the most eminent chemical philosophers in this country, it has been judged most proper to suggest a name founded upon one of its obvious and characteristic properties — its colour, and to call it Chlorine, or Chloric gas.* *From χλωρος."
- ^ Faraday, M. On fluid chlorine. Philosophical Transactions of the Royal Society of London. 1823, 113: 160–164 [2021-06-13]. Bibcode:1823RSPT..113..160F. doi:10.1098/rstl.1823.0016
 . (原始内容存档于2020-04-23).
. (原始内容存档于2020-04-23).
- ^ Chodos, Alan (编). This Month in Physics History September 4, 1821 and August 29, 1831: Faraday and Electromagnetism. American Physical Society. [2010-05-08]. (原始内容存档于June 15, 2010).
- ^ O'Connor J. J.; Robertson E. F. Michael Faraday. School of Mathematics and Statistics, University of St Andrews, Scotland. [2010-05-08]. (原始内容存档于2010-02-20).
- ^ 19.0 19.1 Bleaching. Encyclopædia Britannica 9th Edition (1875) and 10th Edition (1902). [2012-05-02]. (原始内容存档于2012-05-24).
- ^ Aspin, Chris. The Cotton Industry. Shire Publications Ltd. 1981: 24. ISBN 978-0-85263-545-2.
- ^ Paul May. Bleach (Sodium Hypochlorite). University of Bristol. [13 December 2016]. (原始内容存档于13 December 2016).
- ^ 22.0 22.1 22.2 Greenwood and Earnshaw, p. 798
- ^ Almqvist, Ebbe. History of Industrial Gases. Springer Science & Business Media. 2003: 220 [2021-06-14]. ISBN 978-0-306-47277-0. (原始内容存档于2021-12-18).
- ^ 24.0 24.1 Bouvet, Maurice. Les grands pharmaciens: Labarraque (1777–1850) [The great pharmacists: Labarraque (1777–1850)]. Revue d'Histoire de la Pharmacie. 1950, 38 (128): 97–107. doi:10.3406/pharm.1950.8662 (法语).
- ^ Chlorine – History (PDF). [2008-07-10]. (原始内容 (PDF)存档于21 February 2007).
- ^ Weaponry: Use of Chlorine Gas Cylinders in World War I. historynet.com. 2006-06-12 [2008-07-10]. (原始内容存档于2008-07-02).
- ^ Staff. On the Western Front, Ypres 1915. Veteran Affairs Canada. 29 July 2004 [2008-04-08]. (原始内容存档于6 December 2008).
- ^ Lefebure, Victor; Wilson, Henry. The Riddle of the Rhine: Chemical Strategy in Peace and War. Kessinger Publishing. 2004. ISBN 978-1-4179-3546-8.
- ^ 刘怀乐. 化学鉴源与略考. 化学教育. 1994, (04) [2013-02-25]. (原始内容存档于2013-10-04).
- ^ Greenwood and Earnshaw, p. 795
- ^ Holleman, Arnold Frederik; Wiberg, Egon, Wiberg, Nils , 编, Inorganic Chemistry, 由Eagleson, Mary; Brewer, William翻译, San Diego/Berlin: Academic Press/De Gruyter: 408, 2001, ISBN 0-12-352651-5
- ^ The diaphragm cell process. Euro Chlor. [2007-08-15]. (原始内容存档于2011-11-11).
- ^ The membrane cell process. Euro Chlor. [2007-08-15]. (原始内容存档于2011-11-11).
- ^ Schmittinger, Peter; Florkiewicz, Thomas; Curlin, L. Calvert; Lüke, Benno; Scannell, Robert; Navin, Thomas; Zelfel, Erich; Bartsch, Rüdiger, Chlorine, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2006-01-15, ISBN 3-527-30673-0, doi:10.1002/14356007.a06_399.pub2
- ^ 35.0 35.1 35.2 35.3 35.4 35.5 35.6 35.7 Greenwood and Earnshaw, pp. 800–4
- ^ 36.0 36.1 36.2 Greenwood and Earnshaw, pp. 804–09
- ^ Cameron, A. G. W. Abundance of the Elements in the Solar System (PDF). Space Science Reviews. 1973, 15 (1): 121–46. Bibcode:1973SSRv...15..121C. S2CID 120201972. doi:10.1007/BF00172440. (原始内容 (PDF)存档于2011-10-21).
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik. The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A. 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. ISSN 0375-9474. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ M. Zreda; et al. Cosmogenic chlorine-36 production rates in terrestrial rocks. Earth and Planetary Science Letters. 1991, 105 (1–3): 94–109. Bibcode:1991E&PSL.105...94Z. doi:10.1016/0012-821X(91)90123-Y.
- ^ M. Sheppard and M. Herod. Variation in background concentrations and specific activities of 36Cl, 129I and U/Th-series radionuclides in surface waters. Journal of Environmental Radioactivity. 2012, 106: 27–34. PMID 22304997. doi:10.1016/j.jenvrad.2011.10.015.
- ^ Greenwood and Earnshaw, pp. 853–56
- ^ 42.0 42.1 42.2 Greenwood and Earnshaw, pp. 809–12
- ^ Greenwood and Earnshaw, pp. 812–16
- ^ Greenwood and Earnshaw, pp. 818–19
- ^ 45.0 45.1 45.2 Greenwood and Earnshaw, pp. 821–44
- ^ Greenwood and Earnshaw, pp. 842–44
- ^ 47.0 47.1 47.2 Greenwood and Earnshaw, pp. 824–8
- ^ Greenwood and Earnshaw, pp. 835–42
- ^ Greenwood and Earnshaw, pp. 828–31
- ^ Greenwood and Earnshaw, pp. 832–35
- ^ Greenwood and Earnshaw, pp. 875–80
- ^ 52.0 52.1 52.2 52.3 52.4 52.5 52.6 52.7 Greenwood and Earnshaw, pp. 844–50
- ^ Greenwood and Earnshaw, pp. 883–5
- ^ 54.0 54.1 Greenwood and Earnshaw, pp. 856–70
- ^ 55.0 55.1 55.2 M. Rossberg et al. "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2
- ^ 56.0 56.1 Gordon W. Gribble. Naturally Occurring Organohalogen Compounds. Acc. Chem. Res. 1998, 31 (3): 141–52. doi:10.1021/ar9701777.
- ^ Gordon W. Gribble. The diversity of naturally occurring organobromine compounds. Chemical Society Reviews. 1999, 28 (5): 335–46. doi:10.1039/a900201d.
- ^ Kjeld C. Engvild. Chlorine-Containing Natural Compounds in Higher Plants. Phytochemistry. 1986, 25 (4): 7891–791. doi:10.1016/0031-9422(86)80002-4.
- ^ Gribble, G. W. The Natural production of chlorinated compounds. Environmental Science and Technology. 1994, 28 (7): 310A–319A. Bibcode:1994EnST...28..310G. PMID 22662801. doi:10.1021/es00056a712.
- ^ Gribble, G. W. Naturally occurring organohalogen compounds - A comprehensive survey. Progress in the Chemistry of Organic Natural Products. 1996, 68 (10): 1–423. PMID 8795309. doi:10.1021/np50088a001.
- ^ Public Health Statement – Chloromethane 互联网档案馆的存檔,存档日期2007-09-27., Centers for Disease Control, Agency for Toxic Substances and Disease Registry
- ^ Connell, D.; et al. Introduction to Ecotoxicology. Blackwell Science. 1999: 68. ISBN 978-0-632-03852-7.
- ^ Greenwood 1997,第798頁.
- ^ Greenwood 1997,第793頁.
- ^ 65.0 65.1 Greenwood and Earnshaw, pp. 796–800
- ^ 66.0 66.1 Hoefer, Jean Chrétien Ferdinand (编). Labarraque, Antoine-Germain. Nouvelle biographie universelle 28. : 323–24. OL 24229911M.
- ^ 67.0 67.1 Knight, Charles. Arts and sciences 1. Bradbury, Evans & Co. 1867: 427.
- ^ Gédéon, Andras. Science and technology in medicine. Springer. 2006: 181–82. ISBN 978-0-387-27874-2. (原始内容存档于2015-12-31).
- ^ Labarraque, Antoine Germain. On the disinfecting properties of Labarraque's preparations of chlorine. Translated by James Scott. 1828: 8. (原始内容存档于2015-12-31).
- ^ Joseph Cotruvo, Victor Kimm, Arden Calvert. “Drinking Water: A Half Century of Progress.” (页面存档备份,存于互联网档案馆) EPA Alumni Association. March 1, 2016.
- ^ Hammond, C. R. The Elements, in Handbook of Chemistry and Physics 81st. CRC press. 2000. ISBN 978-0-8493-0481-1.
- ^ Koski T. A.; Stuart L. S.; Ortenzio L. F. Comparison of chlorine, bromine, iodine as disinfectants for swimming pool water. Applied Microbiology. 1966, 14 (2): 276–79. PMC 546668
 . PMID 4959984. doi:10.1128/AEM.14.2.276-279.1966.
. PMID 4959984. doi:10.1128/AEM.14.2.276-279.1966.
- ^ Disinfection with chloramine. Centers for Disease Control and Prevention (CDC). Atlanta, Georgia, USA. [2019-01-20]. (原始内容存档于2019-01-20).
- ^ Greenwood 1997,第860頁.
- ^ Wiberg 2001,第411頁.
- ^ "Battle of Ypres" The Canadian Encyclopedia
- ^ Everts, Sarah. When Chemicals Became Weapons of War. Chemical & Engineering News. February 23, 2015, 93 (8). (原始内容存档于March 30, 2016).
- ^ Smil, Vaclav. Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production. 2004-04-01: 226. ISBN 978-0-262-69313-4. (原始内容存档于2015-12-31).
- ^ Weapons of War: Poison Gas. First World War.com. [2007-08-12]. (原始内容存档于2007-08-21).
- ^ Mahdi, Basim. Iraq gas attack makes hundreds ill. CNN. 2007-03-17 [2007-03-17]. (原始内容存档于2007-03-17).
- ^ 'Chlorine bomb' hits Iraq village. BBC News. 2007-05-17 [2007-05-17]. (原始内容存档于2007-05-26).
- ^ Morris, Loveday. Islamic State militants allegedly used chlorine gas against Iraqi security forces. The Washington Post. 2014-10-23 [2021-06-08]. (原始内容存档于2021-12-19).
- ^ Lab report on chlorine gas usage (PDF). Kurdistan Region Security Council. March 14, 2015 [2021-06-15]. (原始内容存档 (PDF)于2023-12-30).
- ^ Gladstone, Rick. Syria Used Chlorine Bombs Systematically in Aleppo, Report Says. The New York Times. 2017-02-13 [2017-05-10]. (原始内容存档于2017-05-15).
- ^ Syrian forces 'drop chlorine' on Aleppo. BBC News. 2016-09-07 [2017-05-10]. (原始内容存档于2017-05-13).
- ^ Ignoring UN, Russia and Assad continue Syrian chemical weapons and bombing attacks labeled war crimes. 2017-03-06 [2017-05-11]. (原始内容存档于2017-04-25).
- ^ "Timeline of investigations into Syria's chemical weapons" (页面存档备份,存于互联网档案馆). Reuters. April 9, 2018.
- ^ "Syrian air force behind 2018 chlorine attack on Saraqeb, OPCW finds" (页面存档备份,存于互联网档案馆) BBC News. April 12, 2021.
- ^ 89.0 89.1 中华人民共和国国家卫生健康委员会. 中国居民膳食营养素参考摄入量 第 2 部分:常量元素 (PDF). [2021-12-01]. (原始内容存档 (PDF)于2020-10-25).
- ^ Blood (Serum) Chloride Level Test. [30 April 2010]. (原始内容存档于31 March 2009).
- ^ Lavie, CJ; Crocker, EF; Key, KJ; Ferguson, TG. Marked hypochloremic metabolic alkalosis with severe compensatory hypoventilation. South. Med. J. October 1986, 79 (10): 1296–99. PMID 3764530. doi:10.1097/00007611-198610000-00025.
- ^ Levitin, H; Branscome, W; Epstein, FH. The pathogenesis of hypochloremia in respiratory acidosis. J. Clin. Invest. December 1958, 37 (12): 1667–75. PMC 1062852
 . PMID 13611033. doi:10.1172/JCI103758.
. PMID 13611033. doi:10.1172/JCI103758.
- ^ Cambier, C; Detry, B; Beerens, D; et al. Effects of hyperchloremia on blood oxygen binding in healthy calves. J. Appl. Physiol. October 1998, 85 (4): 1267–72. PMID 9760315. doi:10.1152/jappl.1998.85.4.1267.
- ^ Food and Nutrition Board, Institute of Medicine, National Academies of Sciences. Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes (PDF). [2021-12-01]. (原始内容存档 (PDF)于2021-12-18).
- ^ Chlorine 295132. [2021-06-13]. (原始内容存档于2020-05-10).
- ^ Facts About Chlorine. www.bt.cdc.gov. [2016-04-12]. (原始内容存档于2016-04-23).
- ^ Chlorine MSDS (PDF). 1997-10-23. (原始内容 (PDF)存档于2007-09-26).
- ^ NOAA Office of Response and Restoration, US GOV. Chlorine. noaa.gov. [25 August 2015]. (原始内容存档于15 October 2015).
- ^ 99.0 99.1 NIOSH Pocket Guide to Chemical Hazards. #0115. NIOSH.
- ^ Winder, Chris. The Toxicology of Chlorine. Environmental Research. 2001, 85 (2): 105–14. Bibcode:2001ER.....85..105W. PMID 11161660. doi:10.1006/enrs.2000.4110.
- ^ What's in your Water?: Disinfectants Create Toxic By-products. ACES News. College of Agricultural, Consumer and Environmental Sciences – University of Illinois at Urbana-Champaign. 2009-03-31 [2009-03-31]. (原始内容存档于2014-09-03).
- ^ Richardson, Susan D.; Plewa, Michael J.; Wagner, Elizabeth D.; Schoeny, Rita; DeMarini, David M. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: A review and roadmap for research. Mutation Research/Reviews in Mutation Research. 2007, 636 (1–3): 178–242. PMID 17980649. doi:10.1016/j.mrrev.2007.09.001.
- ^ Berezow, Alex. Why You Should Never Mix Different Drain Cleaners. Forbes. [2016-04-12]. (原始内容存档于2016-04-25).
- ^ Bleach Mixing Dangers : Washington State Dept. of Health. www.doh.wa.gov. [2016-04-12]. (原始内容存档于2016-04-14).
- ^ Bertolini, Luca; Elsener, Bernhard; Pedeferri, Pietro; Polder, Rob B. Corrosion of steel in concrete: prevention, diagnosis, repair. Wiley-VCH. 2004: 148 [2021-06-13]. ISBN 978-3-527-30800-2. (原始内容存档于2020-06-14).
- ^ Lewis, P.R. Polymer Product Failure. iSmithers Rapra Publishing. 1 January 2000: 19– [2011-04-30]. ISBN 978-1-85957-192-7. (原始内容存档于10 May 2013).
- ^ 107.0 107.1 Chlorine: Product Datasheet (PDF). Bayer MaterialScience AG. 2008-04-21 [2013-12-17]. (原始内容 (PDF)存档于September 15, 2012).
- ^ 108.0 108.1 Sanders, Roy E. Chemical Process Safety: Learning from Case Histories, 3rd Revised edition. Oxford: Elsevier Science & Technology. 2004: 92. ISBN 978-0-7506-7749-3.
- Greenwood, Norman N; Earnshaw, Alan. Chemistry of the Elements 2. Oxford: Butterworth-Heinemann. 1997. ISBN 0-08-037941-9.
- Wiberg, Egon; Wiberg, Nils; Holleman; Arnold Frederick. Inorganic Chemistry. Academic Press. 2001. ISBN 0-12-352651-5.
外部連結
[编辑]- 元素氯在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 氯(英文)
- 元素氯在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素氯在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 氯(英文)
- Agency for Toxic Substances and Disease Registry: Chlorine
- Electrolytic production
- Production and liquefaction of chlorine
- Chlorine Production Using Mercury, Environmental Considerations and Alternatives
- National Pollutant Inventory – Chlorine
- National Institute for Occupational Safety and Health – Chlorine Page (页面存档备份,存于互联网档案馆)
- Chlorine Institute (页面存档备份,存于互联网档案馆) – Trade association representing the chlorine industry
- Chlorine Online (页面存档备份,存于互联网档案馆) – the web portal of Eurochlor – the business association of the European chlor-alkali industry







