镧
鑭並不單獨存在於自然界中,通常伴隨著鈰等其他稀土元素一同出現。1839年,镧首次由瑞典化學家卡爾·古斯塔夫·莫桑德在硝酸鈰的雜質中發現,以古希臘文λανθάνειν(lanthanein,意為“隱藏”)命名。雖然鑭被歸類為稀土元素,但鑭在地殼中元素豐度的排名為第28,幾乎是鉛的三倍。在獨居石和氟碳鈰礦等稀土礦物中,鑭約佔鑭系元素總含量的四分之一,是含量第三多的鑭系及稀土元素[4]。由於稀土元素彼此間的化學性質極度相似,分離的過程非常複雜而困難,因此直到1923年科學家才成功提取出純鑭金屬。
鑭金屬及其化合物有著多種用途,例如催化劑、玻璃添加劑、碳弧燈、打火機的發火部件、真空管的熱陰極、閃爍體、GTAW電極等。此外,碳酸鑭可用作去除腎衰竭患者血液中含量過高的磷酸鹽之結合劑。
性质
[编辑]物理性质
[编辑]镧是元素周期表中的第一個镧系元素。在周期表中,它位於碱土金属钡的右侧和镧系元素铈的左侧。它的位置一直存在争议,但大多数与2021年IUPAC临时报告一起研究此事的人认为,镧最适合作为f区的第一个元素。[5][6][7][8][9]镧原子的电子排布为 [Xe]5d16s2,在惰性气体核心外有三个电子。在化学反应中,镧几乎总是从5d和6s电子壳层中丢弃这三个价电子,形成+3氧化态,实现惰性气体氙的稳定构型。[10]一些镧(II)的化合物是已知的,但它们较不稳定。[11]
在镧系元素中,镧是一个例外,因为它的气相原子中没有4f电子。因此,它只有非常微弱的顺磁性,而之後的镧系元素皆为强顺磁性(除了最后两个镧系元素镱和镥,它们的4f壳层完全充满)。[12]然而,镧的4f壳层可以在化学环境中部分占据并参与化学键合。[13]例如,三价镧系元素(除铕和镱之外的所有镧系元素)的熔点与6s、5d和4f电子的杂化程度有关(随着4f参与度的增加而降低),[14]而镧是其中熔点第二低的,为920 °C。(铕和镱的熔点更低,因为它们每个原子离域约两个电子,而不是三个。)[15]f轨道的这种化学可用性证明了镧在f区块中的位置,尽管其基态构型异常[16][17](这仅仅是强电子间排斥的结果,使得占据小且靠近核心电子的4f壳层的利润降低)。[18]
根據元素週期律,镧系元素的硬度隨著原子序數的增大而逐漸變高。因此身為第一個鑭系元素,镧是較柔软的金属。镧在室温下具有相对较高的电阻率,为 615nΩm。相較之下,良好导体铝的电阻率仅为 26.50nΩm。[19][20]镧是所有镧系元素中挥发性最低的。[21]类似大部分镧系元素,镧在室温下是六方晶系的。到了310 °C,镧的晶体结构变成面心立方晶系,到了865 °C则变成体心立方晶系。[20]
化学性质
[编辑]根据周期表趋势,镧在镧系元素中具有最大的原子半径。因此,它是除了銪之外反应活性最强的镧系元素,在空气中會很快失去光泽,几个小时后完全变黑。鑭在空氣中很容易就能燃烧,形成氧化镧(La2O3),它的碱性几乎和氧化钙相仿。[22]一立方公分大小的镧塊会在一年内完全腐蚀,因为它的氧化物会像铁锈一样剝落,而不會像铝、钪、钇和镥那样形成堅固的保护性氧化层。[23]純鑭必須保存在真空或充滿惰性氣體的玻璃管中才能維持其光亮的外觀。
如同其他稀土元素,鑭最常見的氧化態為+3。镧在室温下就能和卤素反应产生三卤化物,和氮、碳、硫、磷、硼、硒、硅和砷等非金属加热会形成二元化合物。[10][11]镧能和水缓慢反应,生成氢氧化镧(La(OH)3)。[24]在稀硫酸中,镧会形成水合三价阳离子 [La(H2O)9]3+,它是无色的,因为La3+没有d或f軌域的电子。[24]镧的鹼性是稀土元素中最强、最硬的。[25]
一些鑭(II)化合物也已被發現,但它們的穩定性和鑭(III)化合物相比要差得多。[11]因此,在命名鑭的化合物時,必須說明其中的鑭之氧化數。
同位素
[编辑]
天然存在的镧由两种同位素组成,分别为稳定的139La和長壽命的原始放射性核種138La。139La组成了天然镧的99.910%,由s-过程(慢中子捕获,存在于低至中等质量恒星中)和r-过程(快中子捕获,存在于核塌缩超新星中)产生,是镧唯一的稳定同位素,因此鑭屬於單一同位素元素。[26]非常罕见的138La是少数原生的奇-奇同位素之一,有1.03×1011年的长半衰期,它是不能通过s-过程或r-过程产生的富质子核素之一。138La和更加稀有的180mTa是在ν-过程中产生的,其中微中子和稳定核素产生作用。[27]剩下的镧同位素都是人工合成的放射性同位素,除了半衰期六万年的137La以外全部半衰期都少于两天,大部分少于一分钟。139La和140La都是铀的裂变产物。[26]
化合物
[编辑]氧化镧是白色固体,可以由镧和氧直接反应而成。由于La3+很大,La2O3是六边形的七配位结构,在高温下转变为氧化钪(Sc2O3)和氧化钇(Y2O3)的六配位结构。它与水反应,形成氢氧化镧,反应过程中放出大量热量并发出嘶嘶声。氢氧化镧将与大气中的二氧化碳反应,形成碱式碳酸盐。[28]
氟化镧不溶于水,可用于La3+的定性无机分析。其它重卤化镧都是非常可溶的潮解性化合物。无水卤化镧是由镧和卤素直接反应而成的,因为加热水合物会使它们水解:举个例子,加热LaCl3的水合物会产生LaOCl。[28]
镧和氢放热反应,产生二氢化物LaH2,它是黑色、可自燃、脆的、具有氟化钙结构的导电化合物。[29]这是非整比化合物,可以伴随着电导率的损失进一步吸收氢,直到达到更像盐的LaH3。[28]类似LaI2和LaI,LaH2可能也是电子盐。[28]
类似钇和其他镧系元素,由于La3+的大离子半径和高电正性,对其键合没有太大的共价性贡献,因此它的配位化学有限。[30]草酸镧在碱金属草酸盐溶液中溶解度不高,而[La(acac)3(H2O)2]在500 °C左右分解。氧是镧配合物中最常见的供体原子,多为离子型化合物,配位数常超过6。八配位配合物最具表征,为四方反棱柱和扭棱锲形体结构。这些高配位物种的配位数可以达到12,像是螯合物La2(SO4)3·9H2O。由于立体化学因素,它们通常具有较低的对称性。[30]
由于镧元素的电子构型,镧化学往往不涉及π键合,因此有机镧化学非常有限。表征最好的有机镧化合物是三茂镧La(C5H5)3(由无水LaCl3和NaC5H5在四氢呋喃里反应而成)以及它的甲基替代衍生物。[31]
历史
[编辑]
1751年,瑞典矿物学家阿克塞尔·弗雷德里克·克龙斯泰特在巴斯特纳斯的矿区发现了一种重矿物,这种矿物之后被命名为硅铈石。三十年后,十五岁、来自拥有硅铈石的家族的威廉·希辛格将其样本发送给卡尔·威廉·舍勒,但舍勒没有在其中发现任何新元素。1803年,在希辛格成为一名铁匠后,他与永斯·贝采利乌斯一起回到矿物中并分离出一种新的氧化物(两年前发现的二氧化铈),他们将其以矮行星谷神星命名为「ceria」。[32]马丁·克拉普罗特在德国同时独立地分离了二氧化铈。[33]1839年至1843年间,瑞典外科医生兼化学家卡尔·古斯塔夫·莫桑德与贝采利乌斯证明「ceria」是多种氧化物的混合物。他分离出另外两种氧化物,将其命名为「lanthana」和「didymia」。[34][35]他在空气中焙烧来部分分解硝酸铈样品,然后用稀硝酸处理生成的氧化物。[36]
由于镧与铈的性质仅略有不同,并且与铈一起出现在其盐中,他便从古希腊文「λανθάνειν」(意为隐藏)命名镧这个元素。[33]较纯的金属镧直到1923年才被分离出来。[11]
存在和生产
[编辑]在稀土元素中,镧的豐度是第三高的,在地壳中的占比為39 mg/kg,仅次于铈的66.5 mg/kg和钕的41.5 mg/kg。镧在地壳中的丰度几乎是铅的三倍。因此,儘管鑭是所謂的稀土元素之一,但實際上並不稀有。[37]镧很少在稀土矿物中擔當主要的組分。以镧占主导地位的矿物十分罕見,例如鑭獨居石和鑭石。[38]

La3+离子的大小与周期表中鑭之后的轻镧系元素(直到钐和铕的镧系元素)相似,因此镧往往与它们一起出现在磷酸盐、硅酸盐和碳酸盐矿物中,例如独居石(MIIIPO4)和氟碳铈矿(MIIICO3F),其中M代表除了钪和放射性的钷以外的所有稀土元素(多为鈰、鑭和釔)。[39]氟碳铈矿中通常缺乏钍和重镧系元素,因此从中提取轻镧系元素所需的工作量较少。矿石经粉碎、研磨后,首先用热浓硫酸处理,放出二氧化碳、氟化氢和四氟化硅。然后,将产物干燥并用水浸出,在溶液中留下輕镧系元素离子(包括镧)。[40]
独居石中通常包含所有稀土元素和錒系元素中的钍,因此分离過程更为复杂。独居石由于其磁性,可以通过反复的电磁分离分离。分离后,用热浓硫酸处理,可得水溶性的稀土硫酸盐。酸性滤液会被氢氧化钠部分中和至pH3~4。钍以氢氧化钍的形式从溶液中沉淀出来并被去除。之后,将溶液用草酸铵处理,将稀土元素转化为其不溶性草酸盐。草酸盐通过退火分解成氧化物。将这些氧化物溶解在硝酸中,移除主要成分之一——铈,其氧化物不溶于硝酸。镧与硝酸铵通过结晶分离为复盐。与其他稀土元素的复盐相比,镧盐的溶解度相对较低,因此会留在残留物中。[11]处理这些残留物时必须小心,因为它们含有釷-232的衰变产物镭-228,一种强γ放射源。[40]镧相对容易提取,因为它只有一种邻近的镧系元素铈,可以利用其容易被氧化为+4态的性质将其去除。此后,镧可以通过La(NO3)3·2NH4NO3·4H2O的分步结晶分离出来,或通过离子交换技术来得到更纯的镧。[40]
金属镧是从其氧化物获得的。将氧化镧和氯化铵或氢氟酸和氟化物在300-400 °C下反应,分别产生氯化镧和氟化镧:[11]
- La2O3 + 6 NH4Cl → 2 LaCl3 + 6 NH3 + 3 H2O
- LaCl3 + 3 Li → La + 3 LiCl
此外,纯镧也可以由在高温下由无水LaCl3和氯化鈉或氯化鉀的熔融混合物电解而成。[11]
用途
[编辑]
历史上,镧的第一个用处是煤气灯紗罩。卡尔·奥尔·冯·威尔斯巴赫使用氧化镧和二氧化锆的混合物(他称之为Actinophor)来做煤气罩,并于1886年获得专利。最初製成的煤气罩燃燒後发出了绿色的光芒,以照明用途來說并不是很成功。他的第一家公司于1887年在阿茨格斯多夫建立了一家工厂,但在1889年失败而倒閉。之後冯·威尔斯巴赫於1891年研發出了以二氧化釷為材料的新型煤氣罩並大獲成功,一度成為多年間歐洲各國的主要照明設備。[41]
镧的现代用途包括:

6 热阴极
- 镍氢电池阳极使用的一种材料是La(Ni
3.6Mn
0.4Al
0.3Co
0.7)。由于剔除其它镧系元素的成本很高,一般使用用含有超过50%镧的混合稀土金属替代纯镧。该化合物是AB
5类型的金属间化合物成分。[42][43]在美国销售的Toyota Prius的许多型号中都可以找到镍氢电池,生产这些较大的镍氢电池需要消耗大量的镧。2008年,Toyota Prius的镍氢电池需要10至15公斤(22至33英磅)的镧。随着工程师推动技术来提高燃油效率,每辆车可能需要两倍的镧。[44][45][46] - 氢海绵合金中包含镧。該合金在可逆吸附过程中能够储存高达自身体积400倍的氢气。每次過程中都会释放热能,因此这些合金有機會應用于节能系统。[20][47]
- 混合稀土金属是可自燃的合金,其中含有25%至45%的镧,用於製造打火機等的發火裝置。[48]
- 氧化镧和六硼化镧在电子真空管中用作热阴极材料,有很强的电子发射率。LaB
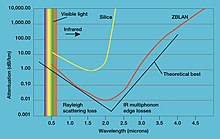
6晶体被用作电子显微镜和霍尔效应推进器的高亮度、长寿命热电子发射源。[49] - 氟化镧(LaF
3)是名为ZBLAN的重氟化物玻璃的重要组成部分。这种玻璃在红外范围内具有优异的透射率,因此用于光纤通信系统。[50] - 掺铈的溴化镧和氯化镧都是近年來的无机闪烁体探测器材料,具有高光输出、最佳能量分辨率和快速响应的性质。此外,其光输出非常稳定,并且在很宽的温度范围内都非常高,使其对高温应用特别有吸引力。这些闪烁体已经在商业上广泛用于中子和γ射线的探测器。[51]
- 碳弧灯使用稀土元素的混合物来提高光质量。直到被淘汰为止,这种应用消耗了大约25%的稀土化合物,其中以电影演播室照明和投影行业的应用為甚。[20][52]
- 加入氧化镧(La
2O
3)可以提高玻璃的耐碱性,用于制作特殊光学玻璃,如红外吸收玻璃。这些玻璃也用于相机和望远镜透镜,因为稀土玻璃具有高折射率和低色散。[20]在氮化硅和二硼化锆的液相烧结过程中,氧化镧也用作晶粒生长添加剂。[53] - 将少量镧添加到钢中可提高其抗冲击性和延展性,而将镧添加到钼中会降低其硬度和对温度变化的敏感性。[20]
- 钨极气体保护电弧焊焊接电极会使用氧化镧,它是放射性的钍的替代品。[54][55]
- 镧和其他稀土元素的各种化合物(氧化物、氯化物等)是各种催化剂的组成部分,例如石油裂化反应催化剂。[56]
- 镧-钡放射性定年法可用于估计岩石和矿石的年龄,但该技术的普及程度有限。[57]
- 许多泳池产品中都含有少量镧,以去除助長藻类孳生的磷酸盐。[58]
- 碳酸镧被批准作为药物,用于在肾衰竭时的高磷酸血症的情况下吸收过量的磷酸盐。[59]
- 氟化镧用于荧光灯涂层。將其与氟化铕混合後,应用于氟离子选择性电极的晶体膜。[11]
- 与辣根过氧化物酶一样,镧在分子生物学中用作电子致密示踪剂。[60]
- 镧改性膨润土在湖泊处理中用于去除水中的磷酸盐。[61]
生物作用
[编辑]镧在人体内没有已知的生物作用。口服的镧很难吸收,注射镧的消除非常缓慢。碳酸镧被批准作为磷酸盐结合剂,在肾衰竭时吸收體內过量的磷酸盐。[59]
镧是嗜甲烷菌Methylacidiphilum fumariolicum SolV的甲醇脱氢酶的重要辅助因子。由於輕镧系元素高度相似,菌體內的镧可以被铈、镨或钕取代而不會產生不良影响,而若以较少量的钐、铕或钆等質量稍重的鑭系元素取代,除了使它們生長緩慢外亦沒有其他副作用。[62]
危害
[编辑]| 镧 | |
|---|---|

| |
| 危险性 | |
GHS危险性符号
| |
| GHS提示词 | Danger |
| H-术语 | H260 |
| P-术语 | P223, P231+232, P370+378, P422[63] |
| NFPA 704 | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
镧具有低到中度的毒性,应小心处理。镧溶液的注射会导致高血糖、低血压、脾脏和肝脏的变性改变。镧在碳弧光中的应用使人们暴露于稀土元素氧化物和氟化物中,有时会导致尘肺。[64][65]由于La3+和Ca2+的大小相似,因此在医学研究中,镧有时被用作钙易于追踪的替代品。[66]镧与其他镧系元素一样,会影响人体新陈代谢,降低胆固醇水平、血压、食欲和凝血风险。镧被注射到大脑中时可以起到止痛药的作用,类似于吗啡和其他阿片类药物,但其背后的机制尚不清楚。[66]
參考資料
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ 钇和所有的镧系元素(Ce和Pm除外)在双(1,3,5-三叔丁基苯)的配合物中展示了0氧化态,见 Cloke, F. Geoffrey N. Zero Oxidation State Compounds of Scandium, Yttrium, and the Lanthanides. Chem. Soc. Rev. 1993, 22: 17–24. doi:10.1039/CS9932200017. 和Arnold, Polly L.; Petrukhina, Marina A.; Bochenkov, Vladimir E.; Shabatina, Tatyana I.; Zagorskii, Vyacheslav V.; Cloke. Arene complexation of Sm, Eu, Tm and Yb atoms: a variable temperature spectroscopic investigation. Journal of Organometallic Chemistry. 2003-12-15, 688 (1–2): 49–55. doi:10.1016/j.jorganchem.2003.08.028.
- ^ Lide, D. R. (编). Magnetic susceptibility of the elements and inorganic compounds. CRC Handbook of Chemistry and Physics (PDF) 86th. Boca Raton (FL): CRC Press. 2005 [2021-10-22]. ISBN 0-8493-0486-5. 原始内容存档于2011-03-03.
- ^ Monazite-(Ce) Mineral Data. Webmineral. [10 July 2016]. (原始内容存档于2021-06-08).
- ^ Fluck, E. New Notations in the Periodic Table (PDF). 純粹與應用化學. 1988, 60 (3): 431–36 [24 March 2012]. S2CID 96704008. doi:10.1351/pac198860030431. (原始内容存档 (PDF)于25 March 2012).
- ^ L. D. Landau, E. M. Lifshitz. Quantum Mechanics: Non-Relativistic Theory Vol. 3 1st. Pergamon Press. 1958: 256–7.
- ^ William B. Jensen. The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table. J. Chem. Educ. 1982, 59 (8): 634–636. Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634.
- ^ Jensen, William B. The positions of lanthanum (actinium) and lutetium (lawrencium) in the periodic table: an update. Foundations of Chemistry. 2015, 17: 23–31 [28 January 2021]. S2CID 98624395. doi:10.1007/s10698-015-9216-1. (原始内容存档于2021-01-30).
- ^ Scerri, Eric. Provisional Report on Discussions on Group 3 of the Periodic Table. Chemistry International. 18 January 2021, 43 (1): 31–34. S2CID 231694898. doi:10.1515/ci-2021-0115.
- ^ 10.0 10.1 Greenwood and Earnshaw, p. 1106
- ^ 11.0 11.1 11.2 11.3 11.4 11.5 11.6 11.7 11.8 Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds. McGraw-Hill. 2003: 444–446 [2009-06-06]. ISBN 978-0-07-049439-8.
- ^ Cullity, B. D. and Graham, C. D. (2011) Introduction to Magnetic Materials, John Wiley & Sons, ISBN 9781118211496
- ^ Wittig, Jörg. The pressure variable in solid state physics: What about 4f-band superconductors?. H. J. Queisser (编). Festkörper Probleme: Plenary Lectures of the Divisions Semiconductor Physics, Surface Physics, Low Temperature Physics, High Polymers, Thermodynamics and Statistical Mechanics, of the German Physical Society, Münster, March 19–24, 1973. Advances in Solid State Physics 13. Berlin, Heidelberg: Springer. 1973: 375–396. ISBN 978-3-528-08019-8. doi:10.1007/BFb0108579.
- ^ Gschneidner Jr., Karl A. 282. Systematics. Jean-Claude G. Bünzli; Vitalij K. Pecharsky (编). Handbook on the Physics and Chemistry of Rare Earths 50. 2016: 12–16. ISBN 978-0-444-63851-9.
- ^ Krishnamurthy, Nagaiyar and Gupta, Chiranjib Kumar (2004) Extractive Metallurgy of Rare Earths, CRC Press, ISBN 0-415-33340-7
- ^ Hamilton, David C. Position of Lanthanum in the Periodic Table. American Journal of Physics. 1965, 33 (8): 637–640. Bibcode:1965AmJPh..33..637H. doi:10.1119/1.1972042.
- ^ Jensen, W. B. Some Comments on the Position of Lawrencium in the Periodic Table (PDF). 2015 [20 September 2015]. (原始内容 (PDF)存档于23 December 2015).
- ^ Jørgensen, Christian. The Loose Connection between Electron Configuration and the Chemical Behavior of the Heavy Elements (Transuranics). Angewandte Chemie International Edition. 1973, 12 (1): 12–19. doi:10.1002/anie.197300121.
- ^ Greenwood and Earnshaw, p. 1429
- ^ 20.0 20.1 20.2 20.3 20.4 20.5 Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ The Radiochemistry of the Rare Earths, Scandium, Yttrium, and Actinium (PDF). [2021-10-22]. (原始内容 (PDF)存档于2021-08-31).
- ^ Greenwood and Earnshaw, p. 1105–7
- ^ Rare-Earth Metal Long Term Air Exposure Test. [2009-08-08]. (原始内容存档于2019-01-30).
- ^ 24.0 24.1 Chemical reactions of Lanthanum. Webelements. [2009-06-06]. (原始内容存档于2021-10-22).
- ^ Greenwood and Earnshaw, p. 1434
- ^ 26.0 26.1 Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik. The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A. 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. ISSN 0375-9474. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Woosley, S. E.; Hartmann, D. H.; Hoffman, R. D.; Haxton, W. C. The ν-process. The Astrophysical Journal. 1990, 356: 272–301. Bibcode:1990ApJ...356..272W. doi:10.1086/168839.
- ^ 28.0 28.1 28.2 28.3 Greenwood and Earnshaw, p. 1107–8
- ^ Fukai, Y. The Metal-Hydrogen System, Basic Bulk Properties, 2d edition. Springer. 2005. ISBN 978-3-540-00494-3.
- ^ 30.0 30.1 Greenwood and Earnshaw, pp. 1108–9
- ^ Greenwood and Earnshaw, p. 1110
- ^ The Discovery and Naming of the Rare Earths. Elements.vanderkrogt.net. [23 June 2016]. (原始内容存档于2021-10-26).
- ^ 33.0 33.1 Greenwood and Earnshaw, p. 1424
- ^ Weeks, Mary Elvira. The discovery of the elements 6th. Easton, PA: Journal of Chemical Education. 1956.
- ^ Weeks, Mary Elvira. The Discovery of the Elements: XI. Some Elements Isolated with the Aid of Potassium and Sodium:Zirconium, Titanium, Cerium and Thorium. The Journal of Chemical Education. 1932, 9 (7): 1231–1243. Bibcode:1932JChEd...9.1231W. doi:10.1021/ed009p1231.
- ^ 参见:
- (Berzelius) (1839) "Nouveau métal" (New metal), Comptes rendus, 8 : 356-357. From p. 356: "L'oxide de cérium, extrait de la cérite par la procédé ordinaire, contient à peu près les deux cinquièmes de son poids de l'oxide du nouveau métal qui ne change que peu les propriétés du cérium, et qui s'y tient pour ainsi dire caché. Cette raison a engagé M. Mosander à donner au nouveau métal le nom de Lantane." (The oxide of cerium, extracted from cerite by the usual procedure, contains almost two fifths of its weight in the oxide of the new metal, which differs only slightly from the properties of cerium, and which is held in it so to speak "hidden". This reason motivated Mr. Mosander to give to the new metal the name Lantane.)
- (Berzelius) (1839) "Latanium — a new metal," (页面存档备份,存于互联网档案馆) Philosophical Magazine, new series, 14 : 390-391.
- ^ It's Elemental — The Periodic Table of Elements. Jefferson Lab. [2007-04-14]. (原始内容存档于29 April 2007).
- ^ Hudson Institute of Mineralogy. Mindat.org. www.mindat.org. 1993–2018 [14 January 2018]. (原始内容存档于2011-04-22).
- ^ Greenwood and Earnshaw, p. 1103
- ^ 40.0 40.1 40.2 Greenwood and Earnshaw, p. 1426–9
- ^ Evans, C. H. (编). Episodes from the History of the Rare Earth Elements. Kluwer Academic Publishers. 2012-12-06: 122 [2021-10-25]. ISBN 9789400902879. (原始内容存档于2022-05-07).
- ^ Inside the Nickel Metal Hydride Battery (PDF). [2009-06-06]. (原始内容 (PDF)存档于2009-02-27).
- ^ Tliha, M.; Mathlouthi, H.; Lamloumi, J.; Percheronguegan, A. AB5-type hydrogen storage alloy used as anodic materials in Ni-MH batteries. Journal of Alloys and Compounds. 2007, 436 (1–2): 221–225. doi:10.1016/j.jallcom.2006.07.012.
- ^ As hybrid cars gobble rare metals, shortage looms. Reuters 2009-08-31. 2009-08-31 [2021-10-25]. (原始内容存档于2021-10-25).
- ^ Bauerlein, P.; Antonius, C.; Loffler, J.; Kumpers, J. Progress in high-power nickel–metal hydride batteries. Journal of Power Sources. 2008, 176 (2): 547. Bibcode:2008JPS...176..547B. doi:10.1016/j.jpowsour.2007.08.052.
- ^ Why Toyota offers 2 battery choices in next Prius. 19 November 2015 [2021-10-25]. (原始内容存档于2021-10-27).
- ^ Uchida, H. Hydrogen solubility in rare earth based hydrogen storage alloys. International Journal of Hydrogen Energy. 1999, 24 (9): 871–877. doi:10.1016/S0360-3199(98)00161-X.
- ^ C. R. Hammond. The Elements, in Handbook of Chemistry and Physics 81st. CRC press. 2000. ISBN 978-0-8493-0481-1.
- ^ Jason D. Sommerville; Lyon B. King. Effect of Cathode Position on Hall-Effect Thruster Performance and Cathode Coupling Voltage (PDF). 43rd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, 8–11 July 2007, Cincinnati, OH. [2009-06-06]. (原始内容 (PDF)存档于July 20, 2011).
- ^ Harrington, James A. Infrared Fiber Optics (PDF). Rutgers University. (原始内容 (PDF)存档于2010-08-02).
- ^ BrilLanCe-NxGen (PDF). [2009-06-06]. (原始内容 (PDF)存档于2011-04-29).
- ^ Hendrick, James B. Rare Earth Elements and Yttrium. Mineral Facts and Problems (报告). Bureau of Mines: 655. 1985 [2021-10-25]. Bulletin 675. (原始内容存档于2022-03-03).
- ^ Kim, K; Shim, Kwang Bo. The effect of lanthanum on the fabrication of ZrB2–ZrC composites by spark plasma sintering. Materials Characterization. 2003, 50: 31–37. doi:10.1016/S1044-5803(03)00055-X.
- ^ Howard B. Cary. Arc welding automation. CRC Press. 1995: 139. ISBN 978-0-8247-9645-7.
- ^ Larry Jeffus. Types of Tungsten. Welding : principles and applications. Clifton Park, N.Y.: Thomson/Delmar Learning. 2003: 350. ISBN 978-1-4018-1046-7. (原始内容存档于2010-09-23).
- ^ C. K. Gupta; Nagaiyar Krishnamurthy. Extractive metallurgy of rare earths. CRC Press. 2004: 441. ISBN 978-0-415-33340-5.
- ^ S. Nakai; A. Masuda; B. Lehmann. La-Ba dating of bastnaesite (PDF). American Mineralogist. 1988, 7 (1–2): 1111 [2021-10-25]. Bibcode:1988ChGeo..70...12N. doi:10.1016/0009-2541(88)90211-2. (原始内容 (PDF)存档于2021-10-31).
- ^ Pool Care Basics. : 25–26.
- ^ 59.0 59.1 FDA approves Fosrenol(R) in end-stage renal disease (ESRD) patients. 28 October 2004 [2009-06-06]. (原始内容存档于2009-04-26).
- ^ Chau YP; Lu KS. Investigation of the blood-ganglion barrier properties in rat sympathetic ganglia by using lanthanum ion and horseradish peroxidase as tracers. Acta Anatomica. 1995, 153 (2): 135–144. ISSN 0001-5180. PMID 8560966. doi:10.1159/000313647.
- ^ Hagheseresht; Wang, Shaobin; Do, D. D. A novel lanthanum-modified bentonite, Phoslock, for phosphate removal from wastewaters. Applied Clay Science. 2009, 46 (4): 369–375. doi:10.1016/j.clay.2009.09.009.
- ^ Pol, Arjan; Barends, Thomas R. M.; Dietl, Andreas; Khadem, Ahmad F.; Eygensteyn, Jelle; Jetten, Mike S. M.; Op Den Camp, Huub J. M. Rare earth metals are essential for methanotrophic life in volcanic mudpots. Environmental Microbiology. 2013, 16 (1): 255–64. PMID 24034209. doi:10.1111/1462-2920.12249.
- ^ Lanthanum 261130. Sigma-Aldrich. [2021-10-24]. (原始内容存档于2023-02-25).
- ^ Dufresne, A.; Krier, G.; Muller, J.; Case, B.; Perrault, G. Lanthanide particles in the lung of a printer. Science of the Total Environment. 1994, 151 (3): 249–252. Bibcode:1994ScTEn.151..249D. PMID 8085148. doi:10.1016/0048-9697(94)90474-X.
- ^ Waring, P. M.; Watling, R. J. Rare earth deposits in a deceased movie projectionist. A new case of rare earth pneumoconiosis. The Medical Journal of Australia. 1990, 153 (11–12): 726–30. PMID 2247001. S2CID 24985591. doi:10.5694/j.1326-5377.1990.tb126334.x.
- ^ 66.0 66.1 Emsley, John. Nature's building blocks: an A-Z guide to the elements. Oxford University Press. 2011: 266–77. ISBN 9780199605637.
参考书目
[编辑]- Greenwood, Norman N.; Earnshaw, A. Chemistry of the Elements. Oxford: Pergamon. 1984. ISBN 0-08-022057-6.
延伸阅读
[编辑]- The Industrial Chemistry of the Lanthanons, Yttrium, Thorium and Uranium, by R. J. Callow, Pergamon Press, 1967
- Extractive Metallurgy of Rare Earths, by C. K. Gupta and N. Krishnamurthy, CRC Press, 2005
- Nouveau Traite de Chimie Minerale, Vol. VII. Scandium, Yttrium, Elements des Terres Rares, Actinium, P. Pascal, Editor, Masson & Cie, 1959
- Chemistry of the Lanthanons, by R. C. Vickery, Butterworths 1953
外部連結
[编辑]- 元素镧在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 镧(英文)
- 元素镧在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素镧在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 镧(英文)
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||||||||||||||||||||||
|




