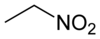
硝基乙烷
| 硝基乙烷 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 硝基乙烷 | |||
| 识别 | |||
| CAS号 | 79-24-3 | ||
| PubChem | 6587 | ||
| ChemSpider | 6338 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | MCSAJNNLRCFZED-UHFFFAOYAB | ||
| UN编号 | UN 2842 | ||
| ChEBI | 16268 | ||
| RTECS | KI5600000 | ||
| KEGG | C01837 | ||
| 性质 | |||
| 化学式 | C2H5NO2 | ||
| 摩尔质量 | 75.07 g·mol−1 | ||
| 密度 | 1.054 g/cm3 | ||
| 熔点 | -90 °C(183 K) | ||
| 沸点 | 115.0 °C(388 K) | ||
| 溶解性(水) | 4.6 g/100 mL(20 °C) | ||
| 蒸气压 | 21 mmHg (25 °C)[1] | ||
| pKa | 16.7[2][3] | ||
| 磁化率 | -35.4·10−6 cm3/mol | ||
| 黏度 | 6.77 泊(20 °C) | ||
| 危险性 | |||
GHS危险性符号  
| |||
| GHS提示词 | 危险 | ||
| H-术语 | H226, H302, H315, H331, H341, H412 | ||
| P-术语 | P210, P261, P312, P301, P330, P304, P340, P312, P370, P378, P403+233 | ||
| 主要危害 | 可燃;有害 | ||
| NFPA 704 | |||
| 爆炸极限 | 3.4%-?[1] | ||
| PEL | TWA 100 ppm (310 mg/m3)[1] | ||
| 致死量或浓度: | |||
LC50(中位浓度)
|
5000 ppm(兔子,2 hr)[4] | ||
LCLo(最低)
|
6250 ppm(小鼠,2 hr)[1] | ||
| 相关物质 | |||
| 相关硝基化合物 | 1-硝基丙烷 2-硝基丙烷 | ||
| 相关化学品 | 亚硝酸乙酯 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
硝基乙烷是分子式为C2H5NO2的有机化合物。在许多方面与硝基甲烷相似,纯硝基乙烷在一般条件下为无色、具有水果味的油性液体。
制备
[编辑]工业上可通过在350–450°C下用硝酸与丙烷反应来生产硝基乙烷。该放热反应会产生四种工业上重要的硝基烷:硝基甲烷、硝基乙烷、 1-硝基丙烷和2-硝基丙烷。该反应涉及自由基形成,例如CH3CH2CH2O·(正丙氧基自由基),是通过相对应的亚硝酸酯均裂作用生成的。这些烷氧基自由基很容易发生碳碳单键断裂反应,这解释了反应产物是混合物的原因 。[5]
或者,可以通过卤代乙烷(例如氯乙烷、溴乙烷或碘乙烷)与亚硝酸银在乙醚或THF中的Victor Meyer反应来生成硝基乙烷。该反应的Kornblum修饰使用在二甲基亚砜或二甲基甲酰胺溶剂中的亚硝酸钠做反应试剂。 [6]
用途
[编辑]透过亨利反应这样的缩合反应,硝基乙烷可被转化为几种具有商业价值的化合物。若此化合物与3,4-二甲氧基苯甲醛缩合,可得到降血压药甲基多巴的前体;与未取代的苯甲醛缩合生成苯基-2-硝基丙烯。硝基乙烷与两当量的甲醛缩合,氢化后可生成2-氨基-2-甲基-1,3-丙二醇,2-氨基-2-甲基-1,3-丙二醇与油酸缩合可生成𫫇唑啉,𫫇唑啉质子化生成阳离子表面活性剂。[5]
像其他一些硝化有机化合物一样,硝基乙烷也被用作燃料添加剂和火箭推进剂的前体。
硝基乙烷是用于聚合物(例如聚苯乙烯)的有用溶剂,并且对于溶解氰基丙烯酸酯粘合剂特别有用。在化妆品应用中,它已被用作人造指甲去除剂和高架天花板密封胶喷雾剂的成分。
以前,硝基乙烷曾在实验室中成功用作化学原料(前驱物),可用于合成多种物质和消费品,例如甲基安非他命,其使用在19世纪和20世纪很普遍(特别是在第二次世界大战期间,盟军和纳粹皆用此药物来刺激士兵情绪,对其食欲和睡眠抑制以及增强注意力,机敏性)。硝基烷烃是用于合成许多苯乙胺衍生物的许多成分之一,包括药物如甲基安非他命和外消旋化合物安非他命 ,[7]一种治疗肥胖的厌食药。 [7]
毒性
[编辑]硝基乙烷被可能认为会造成基因损害,并对神经系统有害。典型的TLV/TWA为100 ppm。典型的STEL为150 ppm。皮肤接触会导致人类患上皮炎。在动物研究中,观察到硝基乙烷暴露会导致流泪,呼吸困难,呼吸异音,水肿,肝肾损害和麻痹。 [8] 曾有儿童因误食人造指甲去除剂,摄取此化合物而中毒。 [9]
参考资料
[编辑]- ^ 1.0 1.1 1.2 1.3 NIOSH Pocket Guide to Chemical Hazards. #0453. NIOSH.
- ^ Reich, Hans. Bordwell pKa table: "Nitroalkanes". University of Wisconsin Chemistry Department. [2016-01-17]. (原始内容存档于2008-10-09).
- ^ Matthews, Walter; et al. Equilibrium acidities of carbon acids. VI. Establishment of an absolute scale of acidities in dimethyl sulfoxide solution. Journal of the American Chemical Society. 1975, 97 (24): 7006. doi:10.1021/ja00857a010.
- ^ Nitroethane. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ 5.0 5.1 Sheldon B. Markofsky “Nitro Compounds, Aliphatic” in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a17_401.
- ^ Agrawal, Jai. Organic Chemistry of Explosives. Chichester, England: John Wiley & Sons. 2007: 7–10. ISBN 9780470029671.[失效链接]
- ^ 7.0 7.1 2016 National Drug Assessment Summary (PDF). Drug Administration. November 2016.[失效链接]
- ^ "Chemical Sampling Information Nitroethane.". [2021-04-01]. (原始内容存档于2017-07-31).
- ^ Hornfeldt CS, Rabe WH. Nitroethane poisoning from an artificial fingernail remover. J. Toxicol. Clin. Toxicol. 1994, 32 (3): 321–4. PMID 8007041. doi:10.3109/15563659409017967.
- ^ MSDS for nitroethane (revised October 3, 2005), as reported by Fisher Scientific..