氯磺酸
| 氯磺酸 | |
|---|---|

| |
| |

| |

| |
| IUPAC名 Sulfurochloridic acid | |
| 識別 | |
| CAS號 | 7790-94-5 |
| PubChem | 24638 |
| ChemSpider | 23040 |
| SMILES |
|
| InChI |
|
| InChIKey | XTHPWXDJESJLNJ-UHFFFAOYAO |
| UN編號 | 1754 |
| RTECS | FX5730000 |
| 性質 | |
| 化學式 | HSO3Cl |
| 摩爾質量 | 116.52 g mol−1 g·mol⁻¹ |
| 外觀 | 無色發煙液體 |
| 密度 | 1.753 g cm−3 |
| 熔點 | −80 °C |
| 沸點 | 151–152 °C (755 mmHg或100.7 kPa) |
| 溶解性(水) | 水解 |
| 溶解性 | 與水和醇反應 可溶於氯代烴中 |
| 折光度n D |
1.433 |
| 結構 | |
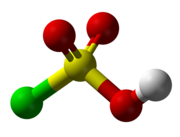
| 分子構型 | 四面體 |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R14, R35, R37 |
| 安全術語 | S:S2, S26, S45 |
| MSDS | ICSC 1039 |
| 歐盟編號 | 016-017-00-1 |
| NFPA 704 | |
| 相關物質 | |
| 相關化學品 | 五氟化銻、三氟甲磺酸、 氫氟酸 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氯磺酸(化學式:HSO3Cl)是一種無色或淡黃色的液體,為劇毒。具有辛辣氣味,在空氣中發煙,是硫酸的一個-OH 基團被氯取代後形成的化合物。分子為四面體構型,取代的基團處於硫酸與硫酰氯之間,有催淚性,主要用於有機化合物的磺化,製取藥物、染料、農藥、洗滌劑等。
製取
[編輯]- HCl + SO3 → HSO3Cl
乾燥的氯化氫氣體通入發煙硫酸,或五氯化磷與濃硫酸反應都可以得到氯磺酸,多用於實驗室中:
- PCl5 + SO2(OH)2 → HSO3Cl + POCl3 + HCl
反應
[編輯]與單質的反應
[編輯]Sn+4HSO3Cl→SnCl4+2H2SO4+2SO2
硒溶於室溫下的氯磺酸,得到深綠色溶液:
8Se+4HSO3Cl→Se82+(深綠色)+2ClSO3-+H2SO4 + 2HCl+SO2
硒溶於熱的氯磺酸,得到黃色溶液:
4Se+4HSO3Cl(熱)→Se42+(黃色)+2ClSO3-+H2SO4 + 2HCl+SO2
碲溶於氯磺酸得到紅色溶液:
4Te+4HSO3Cl→Te42+ (紅色)+2ClSO3-+H2SO4 + 2HCl+SO2
碘在室溫下緩慢地溶於氯磺酸,得到紅棕色的溶液:
5I2+4HSO3Cl→2I5+ (紅棕色)+2ClSO3-+H2SO4 + 2HCl+SO2
氯磺酸與硫反應的產物比較複雜,除了產生二氯化硫和二氧化硫之外,還會根據反應條件的差異而得到兩種不同的多硫陽離子S192+(紅色)和S42+(黃色)
與氧化物的反應
[編輯]- HSO3Cl + H2O → H2SO4 + HCl
- HSO3Cl + H2O2 → H2SO5 + HCl
- 2HSO3Cl + H2O2 → H2S2O8 + 2HCl
與氮氧化物反應得到硝基陽離子或亞硝基陽離子:
與砷、銻、鉍的氧化物反應得到對應的MOSO3Cl (Oxychlorosulfonate):
- M2O3 + 3HSO3Cl →2MOSO3Cl + H2SO4 + HCl
- (M=As,Sb,Bi)
此外,五氧化二釩、二氧化鈰、二氧化釷和三氧化二鑭與氯磺酸反應分別得到弱電解質H[VO(SO3Cl)4],Ce(SO3Cl)4,H2[Th(SO3Cl)6],H[La(SO3Cl)4][1]
與有機物的反應
[編輯]氯磺酸可用於製備磺酰氯。
Ar-H + 2HSO3Cl → Ar-SO2Cl+HCl+H2SO4
參見
[編輯]參考資料
[編輯]- ^ Cremlyn, R. J. Chlorosulfonic Acid: A Versatile Reagent. Royal Society of Chemistry https://books.google.com/books?id=qmwoDwAAQBAJ&pg=PA228&lpg=PA226#v=onepage&q&f=false. 2007-10-31 [2023-11-06]. ISBN 978-1-84755-050-7. (原始內容存檔於2023-11-06) (英語). 缺少或
|title=為空 (幫助)
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001, pages 549-550 (discussion of XSO2OH for X = F, Cl, Br, I)
- R.J. Cremlyn, "Chlorosulfonic Acid" Springer-Verlag New York, Inc. (Royal Society of Chemistry, 2002, 300 pp. ISBN 978-0-85404-498-6




