叔丁基氯
外观
| 叔丁基氯 | |||
|---|---|---|---|
| |||
| IUPAC名 2-氯-2-甲基丙烷 | |||
| 别名 | 见内文 | ||
| 识别 | |||
| CAS号 | 507-20-0 | ||
| PubChem | 10486 | ||
| ChemSpider | 10054 | ||
| SMILES |
| ||
| InChI |
| ||
| UN编号 | 1127 | ||
| EINECS | 208-066-4 | ||
| RTECS | TX5040000 | ||
| 性质 | |||
| 化学式 | C4H9Cl | ||
| 摩尔质量 | 92.57 g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
| 密度 | 0.89 g cm−3 | ||
| 熔点 | −26 ℃ | ||
| 沸点 | 51 ℃ | ||
| 蒸气压 | 34.9 kPa (20 ℃) | ||
| 危险性 | |||
| 警示术语 | R:R12, R36/37/38 | ||
| 安全术语 | S:S7, S9, S16, S29, S33 | ||
| 欧盟分类 | |||
| NFPA 704 | |||
| 闪点 | −9 ℃(开杯) −23 ℃(闭杯) | ||
| 自燃温度 | 540 ℃ | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
叔丁基氯(IUPAC命名:2-甲基-2-氯丙烷)是一种有机化合物,在室温下为无色的液体,分子式为C4H9Cl。
性质
[编辑]叔丁基氯微溶于水,在溶解过程中,有进行自发性溶剂解(水解)的趋势。它有易燃性和挥发性,主要用途是作为起始分子进行亲核取代反应,以合成从叔丁醇到叔丁醇盐的一系列物质。
叔丁基氯溶于极性质子溶剂水时,C-Cl键容易极化,Cl−离去,生成稳定的叔丁基碳正离子,并与一个水分子反应形成叔丁醇,同时生成盐酸。如果用更强的亲核试剂来进行此反应,产物不一定为醇,而是其他含叔丁基的化合物。
其他名称:叔丁氯、1,1-二甲基氯乙烷、1-氯-1,1-二甲基乙烷、2-氯异丁烷、2-甲基-2-氯丙烷、氯三甲基甲烷、三甲基氯甲烷、t-氯丁烷、tert-氯丁烷、t-BuCl、UN 1127。
制取
[编辑]实验原理
[编辑]在实验室中,叔丁基氯可通过叔丁醇与浓盐酸的SN1 反应合成,如下图所示。
| 第 一 步 |

|
酸使醇质子化,形成一个良好的离去基团(水)。 |
| 第 二 步 |
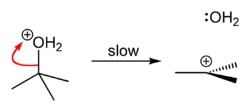
|
水从质子化的叔丁醇上离去,形成较稳定的三级碳正离子。 |
| 第 三 步 |

|
氯离子进攻碳正离子,生成叔丁基氯。 |
总反应为:
由于叔丁醇是三级醇,在第二步中生成的叔丁基碳正离子相对较稳定,使得后续反应遵循SN1机理,而伯醇则会遵循SN2机理。
实验步骤
[编辑]- 将叔丁醇和浓盐酸混合振荡 10~15 min 后转移到分液漏斗中。
- 静置待液体分层打开活塞放掉下层水相,然后往分液漏斗中加入去离子水洗涤,然后通过分液操作弃去下层水相。再往分液漏斗中加入 5% 的碳酸氢钠溶液洗涤以除去残留的盐酸,弃去水相。最后往分液漏斗加入去离子水洗涤以除去残留的碳酸氢钠和氯化钠,弃去水相。
- 取出有机相,加入适量无水氯化钙作为干燥剂,振荡至呈澄清状态,说明已经干燥完毕。
- 过滤掉氯化钙后采用水浴加热的方式将液体进行蒸馏,收集 50~51℃ 的馏分,接收瓶置于冰水浴中。[1]
注意事项
[编辑]- 在分液操作时应该将水层放净,否则有机层中会混有水而影响后续的干燥和蒸馏操作。
- 在用无水氯化钙干燥时不应加得太多,否则有机相会被氯化钙吸附而导致产量降低。
- 蒸馏时必须采用水浴加热而不能直接空气浴加热,因为叔丁基氯的沸点只有 51℃,接收瓶用冰水浴同样是减弱了叔丁基氯的挥发。
参见
[编辑]参考资料
[编辑]- ^ 曾和平 (编). 有机化学实验(第四版) 2014年6月第4版. 北京: 高等教育出版社. 2014-06: 103. ISBN 978-7-04-039976-9.