酰氯

酰氯(英语:acyl chloride 或 acid chloride)是指含有 -C(O)Cl 官能团的化合物,属于酰卤的一类,是羧酸中的羟基被氯替换后形成的羧酸衍生物。最简单的酰氯是甲酰氯,但甲酰氯非常不稳定,不能像其他酰氯一样通过甲酸与氯化试剂反应得到。常见的酰氯有:乙酰氯、苯甲酰氯、草酰氯、氯乙酰氯、三氯乙酰氯、光气等。
酰氯也指各种无机含氧酸的衍生物,通式为 -M(=O)Cl。M一般为非金属元素,如C、P、S等。一些例子有:亚硝酰氯、硫酰氯、磷酰氯、亚硫酰氯等。
性质
[编辑]低级酰氯是有刺鼻气味的液体,高级的为固体。由于分子中没有缔合,酰氯的沸点比相应的羧酸低。酰氯不溶于水,低级的遇水分解。由于氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很弱,因此酰氯中C-Cl键并不比氯代烷中C-Cl键短。
制备
[编辑]酰氯最常用的制备方法是用亚硫酰氯、三氯化磷、五氯化磷与羧酸反应制得。
- R-COOH + SOCl2 → R-COCl + SO2 + HCl
- 3R-COOH + PCl3 → 3R-COCl + H3PO3
- R-COOH + PCl5 → R-COCl + POCl3 + HCl
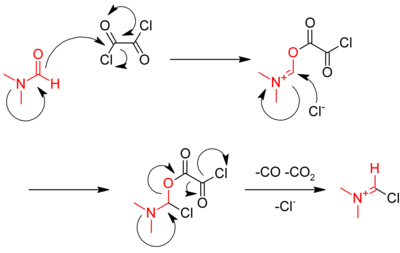
其中一般用亚硫酰氯,因为产物二氧化硫和氯化氢都是气体,容易分离,纯度好,产率高。亚硫酰氯的沸点只有79°C,稍过量的亚硫酰氯可以通过蒸馏被分离出来。用亚硫酰氯制备酰氯的反应可以被二甲基甲酰胺所催化。[1]反应机理为:
也可以用草酰氯作氯化试剂,与羧酸反应制备酰氯:
- R-COOH + ClCOCOCl → R-COCl + CO + CO2 + HCl
这个反应同样受到二甲基甲酰胺的催化。机理中,第一步是二甲基甲酰胺与草酰氯作用生成一个活性的亚胺盐中间体。
然后羧酸与此中间体反应,生成酰氯,并重新得到二甲基甲酰胺:
此外酰氯也可由羧酸、四氯化碳和三苯基膦发生Appel反应得到:[2]
- R-COOH + Ph3P + CCl4 → R-COCl + Ph3PO + CHCl3
反应
[编辑]亲核酰基取代反应
[编辑]酰氯中的氯原子有吸电子效应,增强了碳的亲电性,使酰氯更容易受到亲核试剂的进攻,而且 Cl− 也是一个很好的离去基团,因此酰氯发生亲核酰基取代反应的活性在所有羧酸衍生物中最强。最简单的例子,便是低级酰氯遇水发生的水解反应:
- RCOCl + H-OH → RCOOH + HCl
除此之外,酰氯还可以与氨/胺反应生成酰胺(氨解),与醇反应生成酯(醇解),与羧酸根离子反应生成酸酐等。反应中一般加入碱(如氢氧化钠、吡啶或胺)来催化反应,并吸收反应的副产物氯化氢。由于酰氯比相应的羧酸活性更强,用酰氯作原料的反应也往往产率更高,因此制取酰胺、酯、酸酐时也往往以酰氯为原料,而不是羧酸。
有机金属试剂
[编辑]与格氏试剂反应时,一分子的格氏试剂与酰氯反应生成酮,然后第二分子格氏试剂可以再将酮转化为三级醇。与活性较低的二烷基铜锂和有机镉试剂反应时,反应只生成酮。芳香酰氯一般不如脂肪酰氯活泼。
还原反应
[编辑]还原反应:用催化氢化、氢化铝锂、二异丁基氢化铝还原时,酰氯转化为一级醇。用1mol的三(叔丁氧基)氢化铝锂还原则生成醛。用中毒的钯催化剂使酰氯发生催化还原时,也会生成醛,这个方法称为Rosenmund还原反应。[4]
亲电芳香取代反应
[编辑]氯化铁或氯化铝等路易斯酸催化时,酰氯可以与芳香化合物发生亲电芳香取代反应(傅-克反应),生成芳香酮。反应的机理为:
一个类似的反应是Nenitzescu反应(或称Nenitshesku反应),是用酰氯与烯烃在路易斯酸作用下反应生成酮[5][6][7][8] 。机理是酰基正离子先与烯烃发生亲电加成生成碳正离子,由于羰基α-氢很活泼,因此消除质子便得到不饱和酮。

参见
[编辑]脚注
[编辑]- ^ Clayden, Jonathan. Organic chemistry. Oxford: Oxford University Press. 2001: 276–296. ISBN 0-19-850346-6.
- ^ "Triphenylphosphine-carbon tetrachloride (页面存档备份,存于互联网档案馆) Taschner, Michael J. e-EROS: Encyclopedia of Reagents for Organic Synthesis, 2001
- ^ K. Venkataraman, and D. R. Wagle. Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides. Tet. Lett. 1979, 20 (32): 3037–3040. doi:10.1016/S0040-4039(00)71006-9.
- ^ William Reusch. Carboxylic Acid Derivatives. VirtualText of Organic Chemistry. Michigan State University. (原始内容存档于2016-05-16).
- ^ Price, C. C. Org. React. 1946, 3, 1. (Review)
- ^ Groves, J. K. The Friedel–Crafts acylation of alkenes. Chem. Soc. Rev. 1972, 1: 73. doi:10.1039/cs9720100073.
- ^ Eyley, S. C. Comp. Org. Syn. 1991, 2, 707-731. (Review)
- ^ Heaney, H. Comp. Org. Syn. 1991, 2, 733-752. (Review)
参考资料
[编辑]- 邢其毅等.《基础有机化学》第三版下册.北京:科学出版社,2005年.页600.ISBN 978-7-04-017755-8.