sp杂化
外观
| sp杂化 | |
|---|---|
| sp杂化后的电子轨道排布 (以碳元素为例) | |
| 参与sp杂化的原子轨道 | |
| s轨道 | 1个 |
| p轨道 | 1个 |
| 含有采用sp杂化原子的分子或离子 | |
| C | C2H2、CO2 |
| N | N2、N2O、HCN |
| 其他 | BeCl2、BeH2、HgCl2 |
sp杂化(英语:sp hybridization)是指一个原子同一电子层内由一个ns轨道和一个np轨道发生杂化的过程。sp杂化是最简单的杂化形式。原子发生sp杂化后,上述ns轨道和一个np轨道便会转化成为两个等价的原子轨道,称为“sp杂化轨道”。两个sp杂化轨道的对称轴夹角为180°,在同一条直线上,故sp杂化也称为“直线型杂化”。[1]
sp杂化一般发生在分子形成过程中。杂化发生前,原子最外层s轨道中的一个电子被激发至p轨道,使将要发生杂化的原子进入激发态;之后,该层的s轨道与三个p轨道中的任意一个发生杂化。此过程中,能量相近的s轨道和p轨道发生叠加,不同类型的原子轨道重新分配能量。
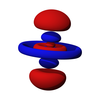
以铍原子为例,铍原子在成键时一般采用sp杂化形式:处于基态的铍原子(电子排布式为:1s22s2)的一个2s电子激发至一个空的2p轨道上,成为激发态(电子排布式为:1s22s12p1)。然后,一个2s轨道再和上述填充了一个电子的2p轨道进行sp杂化,形成两个sp杂化轨道。[2]该过程中铍原子的原子轨道排布变化情况如下图所示:
在有机化学中,碳原子与其他原子以三键连接时(如炔烃中的碳碳三键、腈中的碳氮三键),碳原子均采用sp杂化形式。因为sp杂化产生的键角DCCC为180°,在分子中形成了直线型的区域,使炔烃分子能排列得更加整齐、紧密,这是炔烃熔点较烯烃、烷烃高的原因之一。[3]
参考文献
[编辑]- ^ A.K Srivastava, P.C Jain. Chemistry 1. New Delhi: V.K. (India) Enterprises. 2006: 321. ISBN 978-7-810-82534-4 (英语).
- ^ 潘亚芬、张永士等. 《基础化学》. 21世纪高职高专规划教材·公共基础系列. 北京: 清华大学出版社. 2005年7月1日: 145 [2012年1月20日]. ISBN 81-88597-84-8. (原始内容存档于2016年3月7日) (中文).
- ^ 孔祥文等. 《有机化学》. 北京: 化学工业出版社. 2010年2月: 35 [2012-01-20]. ISBN 978-7-122-07037-1. (原始内容存档于2019-02-17) (中文).