赫克反應
赫克反應(Heck反應)也稱溝呂木-赫克反應(Mizoroki-Heck反應),是不飽和鹵代烴(或三氟甲磺酸酯)與烯烴在強鹼和鈀催化下生成取代烯烴的偶聯反應。[1][2] 它得名於美國化學家理察·赫克和日本人溝呂木勉,赫克憑藉此貢獻得到了2010年諾貝爾化學獎。

原料鹵代烴[3] 或三氟甲磺酸酯中的R基可以是芳基、苯甲基或乙烯基。烯烴的雙鍵碳必須連有氫,且烯烴通常為缺電子烯烴,如丙烯酸酯或丙烯腈。鈀催化劑可以是四(三苯基膦)鈀、氯化鈀(II)或乙酸鈀(II)。鹼可以是三乙胺、碳酸鉀或乙酸鈉。
歷史
[編輯]在 Fujiwara (1967,藤原祐三)[7] 和 Heck(1969年)[8] 此前對芳烴與烯烴以及芳基鹵化汞(ArHgCl)與烯烴在定量鈀(II)催化反應的研究的基礎上,1971年,日本化學家溝呂木報道了乙酸鉀作鹼和氯化鈀催化下,碘苯與苯乙烯在甲醇中、120°C和加壓的條件下偶聯為二苯乙烯的反應。

1972年,Heck獨立報道了碘代苯與苯乙烯的偶聯反應,Heck小組採取無溶劑條件,並改用乙酸鈀催化和有位阻的三正丁胺作鹼。

(上述兩個反應中的活性催化物種鈀(0)都是由鈀與烯烴配位而產生。)
1974年,Heck 向反應引入膦配位基。[9]

反應機理
[編輯]Heck 反應的催化循環是圍繞催化的鈀中心而展開,如下圖所示。循環中所需的活性鈀(0)一般是由鈀(II)前體在反應中原位產生,[10] 例如,乙酸鈀可被三苯基膦還原為雙(三苯基膦)合鈀(0) (1),進入催化循環,同時三苯基膦則被氧化為三苯基氧膦。
循環中,首先是電子不飽和的含鈀物種 (1)與鹵代烴氧化加成,鈀插入到鹵-碳鍵中。然後,鈀原子與烯烴作用產生π錯合物 (3),配位的烯烴再順式插入到鈀-碳鍵中,得 (4)。 (4) 經旋轉(未畫出)異構化為扭張力較小的反式異構物後,發生β-氫脫去反應,獲得另一個鈀與烯烴配位的中間體 (5)。(5) 經解配,即得反應產物烯烴,同時還產生鈀(II)物種 (6),而 (6) 在碳酸鉀作用下發生還原消除,又轉化為 (1),從而獲得再生。可見,反應中用到的碳酸鉀是計量的,但鈀卻是催化性的。
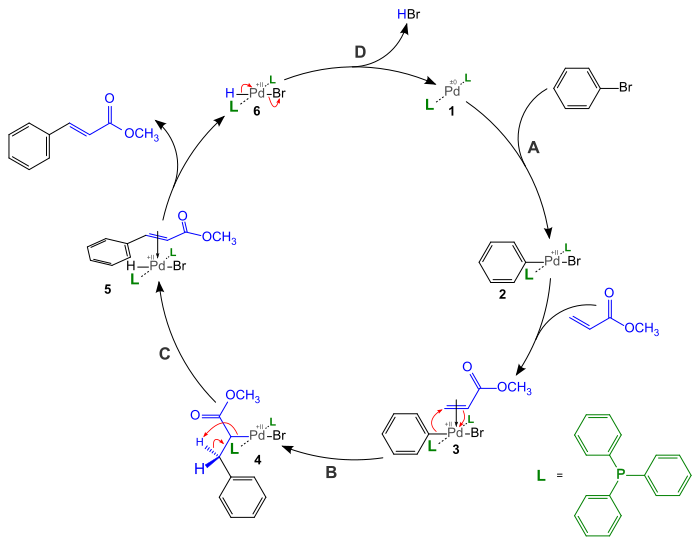
此類催化機理不僅限於乙烯基化合物,其他鈀催化偶聯反應中也可以見到大同小異的循環,例如Sonogashira偶聯反應(一個底物為炔)、Suzuki偶聯反應(烯烴被芳基硼酸替代)和Stille反應(烯烴被芳基錫烷替代)等。循環也可應用於其他10族元素,如Negishi偶聯反應便是有機鋅與芳鹵在鈀或鎳催化下的偶聯,也是採取類似的機理。不過,鉑卻不遵循這一催化循環,因鉑-碳鍵能較高。
立體選擇性
[編輯]Heck 反應具立體選擇性,多產生反式產物,主要原因是體積較大的有機基團與鹵鈀基,在旋轉一步時儘量互相遠離。
此反應工業上用於藥物萘普生(下圖,通過溴萘甲醚與乙烯反應)和防曬霜組分對甲氧基肉桂酸異辛酯的製取。[11]

變體
[編輯]離子液體
[編輯]離子液體存在下,Heck 反應可在無膦配位基的條件下進行。例如,將乙酸鈀和離子液體 (bmim)PF6 負載在反相矽膠的內腔,[12] 可使反應在水中進行,催化劑亦可循環使用。

Heck氧連芳基化
[編輯]順式加成產生的中間體中,鈀上的取代基被羥基取代,最後產生具四氫呋喃環系的產物。[13]

胺基-Heck反應
[編輯]如:以三乙胺為鹼,四(三苯基膦)鈀催化,連有強吸電子基的肟可與末端雙烯發生分子內偶聯,形成具新 C-N 鍵的吡啶衍生物。[14]

參見
[編輯]參考資料
[編輯]- ^ Heck, R. F.; Nolley, Jr., J. P. Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides. J. Org. Chem. 1972, 37(14): 2320–2322. doi:10.1021/jo00979a024.
- ^ Mizoroki, T.; Mori, K.; Ozaki, A. Arylation of Olefin with Aryl Iodide Catalyzed by Palladium. Bull. Chem. Soc. Jap. 1971, 44: 581. doi:10.1246/bcsj.44.581.
- ^ Littke, A. F.; Fu, G. C. (2005). "Heck reactions of aryl chlorides catalyzed by palladium/tri-tert-butylphosphine: (E)-2-Methyl-3-phenylacrylic acid butyl ester and (E)-4-(2-phenylethenyl)benzonitrile". Org. Synth. 81: 63.
- ^ Heck, R. F. Palladium-catalyzed vinylation of organic halides. Org. React. 1982, 27: 345–390. ISBN 978-0471264187. doi:10.1002/0471264180.or027.02.
- ^ A. de Meijere, F. E. Meyer, Jr.;. Fine Feathers Make Fine Birds: The Heck Reaction in Modern Garb. Angew. Chem. Int. Ed. Engl. 1994, 33: 2379–2411. doi:10.1002/anie.199423791.
- ^ Beletskaya, I. P.; Cheprakov, A. V. The Heck Reaction as a Sharpening Stone of Palladium Catalysis. Chem. Rev. 2000, 100: 3009–3066. doi:10.1021/cr9903048.
- ^ Motitani, Ichiro; Fujiwara, Yuzo. Aromatic substitution of styrene-palladium chloride complex. Tetrahedron Letters. 1967, 8: 1119. doi:10.1016/S0040-4039(00)90648-8.
- ^ Heck, Richard F. Mechanism of arylation and carbomethoxylation of olefins with organopalladium compounds. Journal of the American Chemical Society. 1969, 91: 6707. doi:10.1021/ja01052a029.
- ^ Dieck, H. A.; Heck, R. F. Organophosphinepalladium complexes as catalysts for vinylic hydrogen substitution reactions. Journal of the American Chemical Society. 1974, 96: 1133. doi:10.1021/ja00811a029.
- ^ Ozawa, F.; Kubo, A.; Hayashi, T. Generation of Tertiary Phosphine-Coordinated Pd(0) Species from Pd(OAc)2 in the Catalytic Heck Reaction. Chemistry Lett. 1992: 2177–2180. doi:10.1246/cl.1992.2177.
- ^ De Vries, Johannes G. The Heck reaction in the production of fine chemicals. Canadian Journal of Chemistry. 2001, 79: 1086. doi:10.1139/cjc-79-5-6-1086.
- ^ Hagiwara, Hisahiro; Sugawara, Yoshitaka; Hoshi, Takashi; Suzuki, Toshio. Sustainable Mizoroki–Heck reaction in water: remarkably high activity of Pd(OAc)2 immobilized on reversed phase silica gel with the aid of an ionic liquid. Chemical Communications. 2005, (23): 2942–2944. PMID 15957033. doi:10.1039/b502528a.
- ^ Lorand Kiss, Tibor Kurtan, Sandor Antus, Henri Brunner. Further insight into the mechanism of Heck oxyarylation in the presence of chiral ligands (free fulltext). Arkivoc. 2003: GB–653J [2010-10-07]. (原始內容存檔於2006-05-18).
- ^ Mitsuru Kitamura, Daisuke Kudo, and Koichi Narasaka. Palladium(0)-catalyzed synthesis of pyridines from β-acetoxy-γ,δ-unsaturated ketone oximes (free fulltext). Arkivoc. 2005: JC–1563E.
延伸閱讀
[編輯]- Beletskaya, I. P.; Cheprakov, A. V. The Heck Reaction as a Sharpening Stone of Palladium Catalysis. Chem. Rev. 2000, 100: 3009–3066. doi:10.1021/cr9903048.
- Littke, A. F.; Fu, G. C. (2005). "Heck reactions of aryl chlorides catalyzed by palladium/tri-tert-butylphosphine: (E)-2-Methyl-3-phenylacrylic acid butyl ester and (E)-4-(2-phenylethenyl)benzonitrile". Org. Synth. 81: 63.
