碘化亚铜
| 碘化亚铜 | |
|---|---|

| |
| IUPAC名 Copper(I) iodide 碘化铜(I) | |
| 识别 | |
| CAS号 | 7681-65-4 |
| PubChem | 24350 |
| ChemSpider | 22766 |
| SMILES |
|
| InChI |
|
| InChIKey | LSXDOTMGLUJQCM-REWHXWOFAV |
| 性质 | |
| 化学式 | CuI |
| 摩尔质量 | 190.45 [1] g·mol⁻¹ |
| 外观 | 纯品为白色粉末[1],不纯时常带棕色 |
| 密度 | 5.67 g/cm³(固)[1] |
| 熔点 | 591 °C (864 K)[1] |
| 沸点 | 约1290 °C (1573 K)[1] |
| 溶解性(水) | 0.000020 g/100g(20℃)[1] |
| 溶解性 | 难溶于稀酸[1],溶于3.5mol/L碘化钾溶液 |
| 结构 | |
| 晶体结构 | 立方紧密堆积[1] |
| 配位几何 | 四面体型 |
| 相关物质 | |
| 其他阴离子 | 氯化亚铜、氧化亚铜 |
| 其他阳离子 | 碘化银、碘化亚金 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
碘化亚铜(化学式:CuI),即碘化铜(I),白色或无色反磁性粉末,不纯时常为棕色。室温下为闪锌矿结构,应用很广。难溶于水和酸,因形成配合物而易溶于氨水、碘化钾和氰化钾溶液中。自然界中以碘铜矿形式存在。[2]
制备
[编辑]可溶铜(II)盐与碘化钾或碘化钠溶液混合,生成的碘化铜很不稳定,立即分解,得到白色的碘化亚铜沉淀和碘单质。[3]这是实验室中制备碘化亚铜的常用方法,也是分析化学中滴定法测定铜的基础。
- 2 Cu2+ + 4 I− → 2 CuI + I2
加热铜和碘的混合物,铜与热浓氢碘酸反应,或碘离子与氯化亚铜的盐酸溶液反应都可以得到碘化亚铜。
性质
[编辑]碘化亚铜几乎不溶于水(0.00042 g/L,25°C),也不溶于酸,但可以和碘离子继续配位,生成直线型的[CuI2]−离子,从而溶于碘化钾或碘化钠溶液中。得到的溶液经稀释又得到碘化亚铜沉淀,因此可用于纯化碘化亚铜样品。[4]
结构
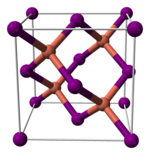
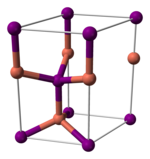
[编辑]与其它卤化亚铜(不稳定的氟化亚铜除外)类似,碘化亚铜的晶体在室温下为闪锌矿结构(ɣ-CuI),两种离子都为四面体配位。加热至390°C时转变为纤锌矿结构(β-CuI),若温度高于440°C,则以氯化钠型结构存在(α-CuI)。由于碘化亚铜中的铜-卤素键键长(2.338 Å)大于另外两个卤化亚铜,故碘化亚铜的这两个转变温度比氯化亚铜和溴化亚铜的相应转变温度都要低。[5]
高温下,三种卤化亚铜的蒸汽中都存在相当数量的环状三聚体(Cu3X3),也有卤化亚铜的四聚体存在。
 |
 |
 |
用途
[编辑]碘化亚铜的用途很广泛,可用作有机合成催化剂、树脂改性剂、人工降雨剂、阳极射线管覆盖物,以及加碘盐中的碘来源。在1,2-或1,3-二胺配体存在下,碘化亚铜可以催化溴代芳烃、溴代杂环化合物和乙烯基溴转化为相应碘化物的反应。反应一般在二噁烷溶剂中进行,以碘化钠作为碘化试剂。芳香碘化物一般比对应的氯化物和碘化物活泼,因此,碘化亚铜可以催化一系列卤代烃参与的偶联反应,例如Heck反应、Sonogashira反应,Stille反应、Suzuki反应及Ullmann反应。[6]2-溴-1-辛烯-3-醇与1-壬炔在二氯双(三苯基膦)合钯(II)、氯化亚铜和二乙胺存在下,发生偶联反应生成7-亚甲基-8-十六碳-6-醇。[7]
参见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–60. ISBN 1-4987-5428-7 (英语).
- ^ Patnaik, P. Handbook of Inorganic Chemicals. McGraw-Hill, New York, (2003). p. 268.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Kauffman, G. B.; Fang, L. Y. "Purification of Copper(I) Iodide" Inorganic Syntheses, 1983, volume 22, pages 101-103. ISBN 0-471-88887-7.
- ^ Wells, A. F. Structural Inorganic Chemistry Oxford University Press, Oxford, (1984). 5th ed., p. 410 and 444.
- ^ Klapars, A.; Buchwald, S. L. "Copper-Cataylzed Halogen Exchange in Aryl Halides: An Aromatic Finkelstein Reaction" J. Am. Chem. Soc, Vol. 124, 50, (2002), p. 14845.
- ^ Marshall, J. A.; Sehon, C. A. "Isomerization of β-alkynyl Allylic Alcohols to Furans Catalyzed by Silver Nitrate on Silica Gel: 2-Pentyl-3-Methyl-5-Heptylfuran [Furan, 5-heptyl-3-methyl-2-pentyl-]" Organic Syntheses, Vol. 76, p.263.
- Macintyre, J. Dictionary of Inorganic Compounds. Chapman and Hall, London, (1992). Vol. 3, p.3103.
| ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
