十羰基二錸:修订间差异
删除的内容 添加的内容
←建立内容为“{{chembox | verifiedrevid = 429135802 | ImageFile1 = Re2(CO)10improved.svg | ImageSize1 = | ImageFile2 = Rhenium-carbonyl-3D-balls.png | ImageSize2 = | ImageFile3 = Re2(CO)10 sample.JPG | ImageSize3 = 280 | IUPACName = bis(pentacarbonylrhenium)(''Re''—''Re'') | OtherNames = 羰基錸、五羰基錸 |Section1={{Chembox Identifiers | ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} | ChemSpiderID = 436546 | InChI = 1/10CO.2Re/c10*1-2;…”的新页面 |
(没有差异)
|
2021年10月3日 (日) 12:08的版本
| 十羰基二錸 | |
|---|---|

| |
| |

| |
| IUPAC名 bis(pentacarbonylrhenium)(Re—Re) | |
| 别名 | 羰基錸、五羰基錸 |
| 识别 | |
| CAS号 | 14285-68-8 |
| PubChem | 518917 |
| ChemSpider | 436546 |
| SMILES |
|
| InChI |
|
| InChIKey | ZIZHEHXAMPQGEK-UHFFFAOYAX |
| 性质 | |
| 化学式 | Re2(CO)10 |
| 摩尔质量 | 652.52 g/mol g·mol⁻¹ |
| 熔点 | 170 °C(443 K) |
| 溶解性(水) | |
| 危险性 | |
| 警示术语 | R:R20 |
| 安全术语 | S:S36 |
| 欧盟分类 | 有害(Xn)
|
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
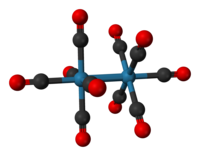
十羰基二錸是一種无机化合物,分子式為Re2(CO)10。它在市面上可獲得,常用作合成許多錸羰基配合物的起點。它首次於1941年由瓦爾特·希貝爾記錄,他將錸還原羰基化製備它。[1]化合物中有一對四角锥形的Re(CO)5單元由一個Re-Re鍵連接,產生一個全同羰基配合物。[2]
結構及性質
十羰基二錸的晶體結構相當熟知。化合物由一對四角錐形的Re(CO)5單位組成,而它們由一個Re-Re鍵連接。此處可以發生兩種构象:交錯式和重疊式。重疊式構象佔所有構象的30%,它會產生一個D4h点群,但點群為D4d的交錯式比較穩定。Re-Re鍵長通過實驗發現為3.04Å。[3]
合成
十羰基二錸可以由七氧化二铼(Re2O7)在350 atm和250 °C下還原羰基化製備。
- Re2O7 + 17 CO → Re2(CO)10 + 7 CO2
反應
羰基配體可以被其他如膦和亚磷酸盐的配體置換(以L標記)。[4]
- Re2(CO)10 + 2 L → Re2(CO)8L2
這個化合物也可以通過卤化「破裂」成單核Re(I)羰基配合物:[5]
- Re2(CO)10 + X2 → 2 Re(CO)5X (X = Cl, Br, I)
加入溴就會生成五羰基溴化錸。它是許多錸配合物的中間體。這個化合物也可以氫化生成各種多錸配合物,最終得到錸元素。[6]
- Re2(CO)10 → H3Re3(CO)12 → H5Re4(CO)12 → Re (metal)
十羰基二錸遇水時,就會經過光解作用轉化為羥基配合物:[7]
- Re2(CO)10 → HRe(CO)5 + Re4(CO)12(OH)4
應用
錸基催化作用可用於複分解反應、重整、氢化以及各種如加氢脱硫的加氫處理過程。[8]十羰基二錸可以用來促進醇的硅烷化(silylation)並製備硅醚,其反應為:[9]
- RSiH3 + R'OH → RH2SiOR' + H2
參見
參考文獻
- ^ W. Hieber; H. Fuchs. Über Metallcarbonyle. XXXVIII. Über Rheniumpentacarbonyl. Zeitschrift für anorganische und allgemeine Chemie. 1941, 248 (3): 256–268. doi:10.1002/zaac.19412480304 (German).
- ^ F. Armstrong; J. Rourke; M. Hagerman; M. Weller; P. Atkins; T. Overton. Shiver and Atkins' Inorganic Chemistry 5th edition: 555. 2010.
- ^ M. Churchill; K. Amoh; H. Wasserman. Redetermination of the crystal structure of dimanganese decacarbonyl and determination of the crystal structure of dirhenium decacarbonyl. Revised values for the manganese-manganese and rhenium-rhenium bond lengths in dimanganese decacarbonyl and dirhenium decacarbonyl. Inorganic Chemistry. 1981, 20 (3): 1609–1612. doi:10.1021/ic50219a056.
- ^ K.S. Suslick; P.F. Schubert. Sonochemistry of dimanganese decacarbonyl (Mn2(CO)10) and dirhenium decacarbonyl (Re2(CO)10). Journal of the American Chemical Society. 1983, 105 (19): 6042–6044. doi:10.1021/ja00357a014.
- ^ Steven P. Schmidt; William C. Trogler; Fred Basolo. Pentacarbonylrhenium Halides. Inorganic Syntheses 28. 2007: 154–159. ISBN 9780470132593. doi:10.1002/9780470132593.ch42.
- ^ C. Dossi, J. Schaefer, W. M. H. Sachtler. Mechanism of particle formation in decomposing Re2(CO)10 on NaY and NaHY zeolites: effect of prereduced Pt clusters in the supercages. Journal of Molecular Catalysis. 1989, 52 (1): 193–209. doi:10.1016/0304-5102(89)80089-6.
- ^ D. R. Gard; T. L. Brown. Photochemical reactions of dirhenium decacarbonyl with water. Journal of the American Chemical Society. 1982, 104 (23): 6340–6347. doi:10.1021/ja00387a031.
- ^ R. Jarkko; A.P. Tapani. Controlled gas-phase preparation and HDS activity of Re2(CO)10 alumina catalysts. Catalysis Letters. 2000, 65 (4): 175–180. S2CID 96952765. doi:10.1023/A:1019006413873.
- ^ D.H.R.Barton, M.J. Kelly. Mechanism and utility of the dirhenium decacarbonyl catalyzed formation of silyl ethers. Tetrahedron Letters. 1992, 33 (35): 5041–5044. doi:10.1002/chin.199302225.
| |||||||||||||||||||||||||||||||||||||||||||
