熵 (古典热力学)
| 热力学的 共轭变数 | |
|---|---|
| 压力 | 体积 |
| (应力) | (应变) |
| 温度 | 熵 |
| 化学势 | 粒子数 |
在古典热力学中,熵是关于一热力学系统之自发变化方向或变化结果的状态参数,于十九世纪中叶由德国物理学家鲁道夫·克劳修斯提出,取自希腊文τρoπή ,意为“转化(transformation)”,用于说明内能是否能转化为热或功。熵指出有些热力学过程虽不违反能量守恒定律但仍然不可行。[1]熵的定义建立了热力学第二定律的核心:孤立系统的熵不随时间递减,系统倾向平衡态,此时熵有最大值。熵有时被视为系统乱度的度量。
奥地利物理学家路德维希·波兹曼发现,熵的本质是为系统之一巨观状态所对应的所有可能微观组态总数Ω。例如处于某一巨观状态之气体的熵,隐含其微观下所有粒子之位置和动量的可能组态数。波兹曼指出热力学熵应等于k lnΩ,其中k为波兹曼常数。
概要[编辑]

热力学系统中各处的温差、密度差和压力差倾向于随时间减少。比方说,置一杯冰块于一房间中,能量将以热的形式流动,房间渐冷、杯子渐热、冰块融化成水,房间、杯子与水终于同温。此时房间的熵已下降,而杯子与水的熵则上升,其上升量大于房间熵的下降量。在像上述由房间、杯子、水构成的孤立系统中,由较高温区域向较低温区域的能量传播必导致熵的净增加。故当系统达到热平衡,其熵达最大值。熵可作为系统均匀化过程的度量。
许多不可逆过程会使熵增加,例如定温定压下移除一容器中不同腔室间的隔板,以混和各腔室内的物质,增加混合熵。在混和理想气体的特例中,系统不会由功或热量散失的形式改变内能,熵增完全由各物质在合并的腔室中分散所致。[2]
在古典热力学中,巨观下的熵是一热力学系统的一种状态参数。换言之,熵仅取决于该系统当下的状态,与形成该状态的过程无关。熵是热力学第二定律的要素,与热机、冰箱与热泵的行为有关。
定义[编辑]
根据克劳修斯不等式,对于一个只进行可逆过程的封闭、均质系统:
其中,是封闭且均温系统中的温度,是依可逆过程进出该系统的热量变化。
也就是说,线积分与积分路径无关。
如此一来,吾人可定义状态参数熵,满足下式:
测量[编辑]
均匀且封闭之系统的热力学状态由其温度T和压力P决定。熵变可写为:
上式第一部分的贡献取决于定压热容:
这是来自于热容的定义δQ = CPdT,并且TdS = δQ。第二部分可依马克士威关系式改写成:
又由体膨胀系数之定义
可推得
由上式,任意状态(P, T)下的熵 S与某一参考状态(P0, T0)及其熵 S0满足关系式:
在古典热力学中,吾人可设任意便于计算之温度、压力为参考状态,并取其熵为零。以纯物质的讨论为例,我们可取气压为1巴、温度为该物质熔点时的固体之熵为零。在更基本的观点下,热力学第三定律暗示我们可取T = 0(绝对零度)时的熵为零,此时物质结构极为有序,例如晶体。
决定参考状态后,透过下述在温度-压力图中的特定路径,可以决定状态S(P, T)下的熵:先定压,对T积分,使得dP = 0;再定温,对P积分,使得dT = 0。熵是状态参数,故积分与路径无关,沿其他路径亦得相同结果。
上述关系式显示,需先求得热容及描述状态之方程(系统内容物的P、V、T之间的关系式),方能求得熵。一般情形中,热容及各参数关系式皆为复杂的函数,必求于数值积分,仅部分特例下得以算得熵的解析表达式。典型的特例有理想气体,其热容为定值,各参数遵从理想气体方程PV = nRT,算得αVV = V/T = nR/p,其中n是莫尔数、R是理想气体常数。如此一来,可求得理想气体每莫尔的熵为:
此处,CP 是莫尔热容。
非均值系统的熵是多个子系统的熵和。即使是非均值系统、远非平衡态,只要各个子系统之热力学参数是良好定义的,则热力学定律依然严格成立。
温-熵图[编辑]

特定物质在不同状态下的的熵可以透过软体制图或制表得知,其中以温熵图为常见。图二是为蒸气之温熵图,显示液态、蒸气、超临界流体、饱和等不同状态的曲线。
不可逆变化中的熵变[编辑]
考虑一个非均值系统,热力学变化可在其中发生。若在内部热力学变化发生前后分别求得熵为S1及S2,则热力学第二定律要求S2 ≥ S1(孤立系统的熵不得随时间递减),不等式等号成立若且唯若该变化为可逆过程。不可逆过程中的熵差Si = S2 − S1称之为“熵生”。
假设一系统与周遭环境间无热量进出、互不作功(孤立系统),例如一绝热且由刚体制成的盒子,内部由可移动的隔板分为两室,分别装有气体。若其中一方的压力大于另一方,气体将推动隔板,对压力低的一方作功。此外,若两方气体处在不同温度,且隔板可导热,则会两室间会有热量流动。前文显示这些情况都会使得系统整体的熵会增加。在这些情况里系统的熵终将达到最大值,该值对应到系统的平衡态,此时任何的改变都会使熵减少而违反热力学第二定律。一旦系统达到这种“最大熵状态”,系统中任一区块都无法对其他区块作功。有鉴于此,我们将熵看作一系统之能量是否能在内部作功的度量。
不可逆过程使热力学系统中的反应渐缓,其作功或降温并带来熵生,而可逆过程中的熵生为零,故熵生可做为不可逆性的度量,常用于工程上与机器上的比较。
热力学机器[编辑]
关于可逆与不可逆热力学过程的研究,让克劳修斯意识到熵这项关键物理量的存在。热机是一种热力学系统内的热力学机器,其运作一连串热力学过程,并且最终回到初始状态,而整串过程称作热力学循环,或简称循环。在其中某些过程里,热机所构成的系统可能与环境交换能量。循环的净结果为:
若循环中所有变化都是可逆的,则循环亦为可逆,也就是说整个循环可以逆著进行,热量流动与做功方向相反,最后净结果中的热量变化及功全部变号。
热机[编辑]
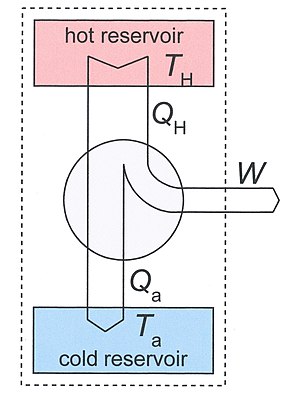
考虑在两温度 TH 和Ta两不同温度之热库间运作的热机。我们考虑环境温度恰为Ta(非必要条件,环境温度可为其他低温),热机分别与两热库接触。热库的热容极大,以致于当热量QH流出高温热库、或热量Qa流入低温热库时,二者温度无显著改变。一般运作下,TH > Ta,且QH、Qa、 W三者皆为正。
两热库及热机三者构成一个热力学系统,即为图三中虚线方框内的模型。这个系统绝热(与环境间无热量进出)、封闭(与环境间无物质进出)、且非均值。不过它并非孤立系统,因为每个循环它都输出一定的功W。由热力学第一定律我们有:
因为热机本身的运作是周期循环的,我们可知其内能在一个循环后不改变,其熵亦然。故一个循环后系统中的熵变化量S2 − S1取决于两热库的温度改变,其相当于热机不可逆过程的熵生Si:
第二定律要求 Si ≥ 0。由两关系式中消去Qa得
第一项是热机所做的功的最大可能值,其发生在热机可逆时,例如卡诺热机。最后:
这个方程式说明熵的产生会减少功的输出。后项TaSi给出机器“失去的功”,或说是散失的能量。
相对应的,熵的产生带来了流入低温热库的“废热”:
上述重要关系式可在没有热库的情形下推导出来,参见熵生。
冷机(冰箱)[编辑]
同样的原理可应用在运作于低温 TL与环境温度间的冷机,示意图恰如图三,仅需将TH换为TL、QH换为QL,并将W反向。此时熵生为
且从低温区转移热量 QL所需消耗的功为
第一项是最少所需的功,最小值发生于可逆冷机。故有
也就是说,冰箱压缩机需要做额外的功来补偿不可逆反应中散失的能量,并导致熵生。
参见[编辑]
参考资料[编辑]
- ^ Lieb, E. H.; Yngvason, J. The Physics and Mathematics of the Second Law of Thermodynamics. Physics Reports. 1999, 310 (1): 1–96. Bibcode:1999PhR...310....1L. S2CID 119620408. arXiv:cond-mat/9708200
 . doi:10.1016/S0370-1573(98)00082-9.
. doi:10.1016/S0370-1573(98)00082-9.
- ^ Notes for a "Conversation About Entropy". [2022-05-03]. (原始内容存档于2021-09-17).
延伸阅读[编辑]
- E.A. Guggenheim Thermodynamics, an advanced treatment for chemists and physicists North-Holland Publishing Company, Amsterdam, 1959.
- C. Kittel and H. Kroemer Thermal Physics W.H. Freeman and Company, New York, 1980.
- Goldstein, Martin, and Inge F., 1993. The Refrigerator and the Universe. Harvard Univ. Press. A gentle introduction at a lower level than this entry.





















