羟醛缩合
| 羟醛缩合 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 反应类型 | 缩合反应 | ||||||||
| 反应 | |||||||||
| |||||||||
| 反应条件 | |||||||||
| 温度 | +Δ, ~100°C
| ||||||||
| 催化剂 | −OH or H+
| ||||||||
| 标识 | |||||||||
| 有机化学网站对应网页 | aldol-condensation | ||||||||
| RSC序号 | RXNO:0000017 | ||||||||
羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。

羟醛缩合在有机合成当中很重要,它是形成碳碳单键的关键条件之一,罗宾逊成环反应中有一步就是羟醛缩合反应。羟醛缩合在大学有机化学课程中常作为一个经典构建碳键的反应进行讲解,并用该反应介绍反应机理。[1][2][3] 在普通的羟醛缩合反应中,包涵了酮的烯醇对于醛的亲核加成,形成β-羟基酮或者“羟醛”(广泛出现于各种天然产物及药物中的一种结构单元)。[4] [5] [6]

羟醛缩合在生物化学中也同样广泛存在。羟醛反应自身由醛缩酶催化,然而该反应不是正式的缩合反应,这是因为过程中并未脱除小分子。
反应在醛和酮之间发生(交叉羟醛缩合),或者在两个醛之间发生,则称为Claisen-Schmidt缩合反应。这些反应都被冠以发现人的名字莱纳·路德维希·克莱森和J.G.施密特。他们分别于1880和1881年发表了自己在该领域的论文。[7][8][9] 一个相关的例子是合成二亚苄基丙酮。
机理
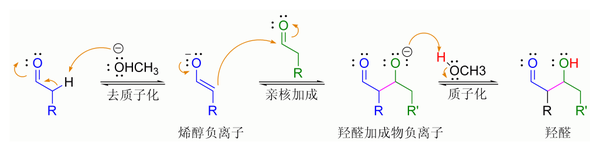
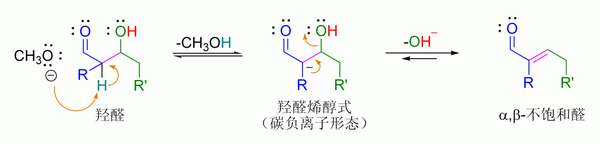
[编辑]反应的第一步为羟醛反应,第二步为脱水反应即消除反应。当分子内有活性羧基的情况下,该脱水反应还会伴随脱羧反应。羟醛加成产物可通过两种机理进行脱水反应:强碱如:叔丁醇钾、氢氧化钾或氢氧化钠通过烯醇机理进行反应,[10] 或通过酸-催化进行的烯醇机理进行反应。
酸催化的羟醛反应机理
酸催化的脱水反应
碱催化的羟醛反应 (图例使用−OCH3做碱)
碱催化的脱水反应 (这里通常被错写为简单一步,见E1cB消除反应)
缩合反应类型
[编辑]区分“羟醛缩合”与其他“对羰基化合物的加成反应”很重要:
- 当碱为胺类化合物,而活性氢化合物进行了充分的活化则该缩合反应称为Knoevenagel缩合反应。
- 在珀金反应中,醛是芳香族的,而烯醇是通过酸酐得到的。
- 克莱森缩合反应中,两个酯化合物进行了缩合反应。
- 狄克曼缩合反应进行了分子内的双酯基缩合反应。
- Henry反应中,醛和一个脂肪族的硝基化合物进行了缩合反应。
- 罗宾逊成环反应中牵涉到了α,β-不饱和酮和羰基基团,先进行Michael反应,然后进行缩合反应。
- Guerbet反应中,醇在反应中生成醛而自身缩合形成二聚的醇。
- Japp–Maitland缩合反应中,水分子并非通过消除反应,而是通过亲核取代反应脱除。
羰醇过程
[编辑]工业生产中,由皇家荷兰壳牌和埃克森开发的一种方法称为“羰醇过程”:通过氢甲酰化将丙烯和合成气直接转化为2-辛醇,然后羟醛缩合为2-乙基己烯醛,最后进行氢化反应。
在一个例子中,巴豆醛在钯/Amberlyst/超临界二氧化碳体系中,直接转化为2-乙基己烯醛。[11]
展望
[编辑]2-甲基乙酰乙酸乙酯和龙脑醛通过羟醛缩合进行反应。[12]该过程[注 1]对于这类反应很典型。在操作过程中,一当量的乙醇,水和二氧化碳在脱羧反应中脱除。

乙醛酸乙酯 2 和2-甲基戊烯二酸二乙酯 1 在乙醇钠条件下反应为 异戊二烯酸 3 (异戊二烯骨架) 和乙醇钠。该反应产物非常不稳定,会失去二氧化碳而进行许多其他反应。这被认为和甲基与二烯烃上的羧基的空间张力有关。[13]

有些时候,羟醛反应是多步反应当中的一步或参与了催化循环,如下列的反应式:[14]
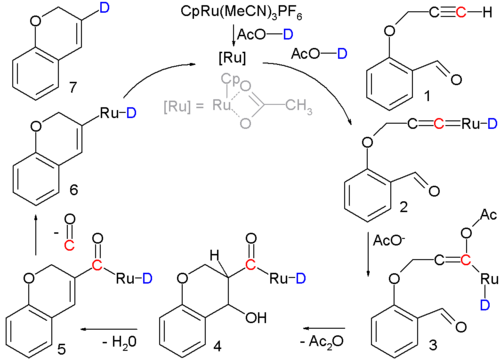
该反应中,炔基醛 1 转化为环烯 7,反应利用了钌催化剂,而真正的缩合反应发生在中间体3到中间体5的阶段。该反应机理基于同位素标记法的验证。[注 2]
薄荷酮和茴香醛之间的反应由于酮基的立体屏蔽效应而变的很复杂。反应选择一个强碱如氢氧化钾和一个极性溶剂如DMSO,反应如下:[15]

由于通过一个普通的烯醇负离子(中间体A)进行差向异构化,反应产物具有(R,R) 顺式构象而不是如原料的(R,S)的反式构象。
参见
[编辑]注解
[编辑]- ^ 2-甲基乙酰乙酸乙酯(2)加入到氢化钠的二氧六环溶液中。然后龙脑烯醛(1)加入反应液,混合体系回流15小时。而后加入2N盐酸,混合物用乙醚萃取。有机层合并,用2N盐酸,饱和的碳酸氢钠溶液和盐水分别洗涤。有机层用无水硫酸钠干燥,过滤并在低压下除去溶剂,得到的残留物使用减压蒸馏进行纯化得到(3),收率58%。
- ^ 所使用的钌催化剂有一个环戊二烯的配体,三个乙腈配体及一个六氟化磷的补偿离子。溶剂乙酸中可解离的氢离子由氘离子来取代,以进行同位素标记。反应条件:90°C,24小时。反应收率为80%。第一个步骤是形成过渡金属卡宾络合物2。在亲核加成反应中乙酸和中间产物反应,形成烯醇负离子3,进行羟醛缩合5,然后在步骤6中脱去一个一氧化碳原子,最后一个步骤是形成环烯的还原消除反应。
外部链接
[编辑]参考文献
[编辑]- ^ Wade, L. G. Organic Chemistry. Upper Saddle River, New Jersey: Prentice Hall. 6th ed. 2005: 1056–1066. ISBN 0132367319.
- ^ Smith, M. B.; March, J. Advanced Organic Chemistry. New York: Wiley Interscience. 5th ed. 2001: 1218–1223. ISBN 0-471-58589-0.
- ^ Mahrwald, R. Modern Aldol Reactions, Volumes 1 and 2. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2004: 1218–1223. ISBN 3-527-30714-1.
- ^ Heathcock, C. H. Comp. Org. Syn.. Oxford: Pergamon. 1991: 133–179. ISBN 0-08-040593-2.
- ^ Mukaiyama, Teruaki, The Directed Aldol Reaction, Hoboken, NJ, USA: John Wiley & Sons, Inc.: 203–331, 1982-08-09, ISBN 0-471-26418-0, doi:10.1002/0471264180.or028.03
- ^ Cowden, Cameron J.; Paterson, Ian, Asymmetric Aldol Reactions Using Boron Enolates, Hoboken, NJ, USA: John Wiley & Sons, Inc.: 1–200, 1997-08-28, ISBN 0-471-26418-0, doi:10.1002/0471264180.or051.01
- ^ Claisen, L.; Claparède, A. Condensationen von Ketonen mit Aldehyden. Berichte der deutschen chemischen Gesellschaft (Wiley-Blackwell). 1881, 14 (2): 2460–2468. ISSN 0365-9496. doi:10.1002/cber.188101402192.
- ^ Schmidt, J. Gustav. Ueber die Einwirkung von Aceton auf Furfurol und auf Bittermandelöl bei Gegenwart von Alkalilauge. Berichte der deutschen chemischen Gesellschaft (Wiley-Blackwell). 1881, 14 (1): 1459–1461. ISSN 0365-9496. doi:10.1002/cber.188101401306.
- ^ Advanced organic Chemistry, Reactions, mechanisms and structure 3ed. Jerry March ISBN 978-0-471-85472-2
- ^ Nielsen, A. T.; Houlihan., W. J. Org. React. 1968, 16, 1-438. (Review)
- ^ Seki, Tsunetake; Grunwaldt, Jan-Dierk; Baiker, Alfons. Continuous catalytic “one-pot” multi-step synthesis of 2-ethylhexanal from crotonaldehyde. Chemical Communications (Royal Society of Chemistry (RSC)). 2007, (34): 3562. ISSN 1359-7345. doi:10.1039/b710129e.
- ^ (E)-6-(2,2,3-Trimethyl-cyclopent-3-enyl)-hex-4-en-3-one Concepcion Bada, Juan M. Castro, Pablo J. Linares-Palomino, Sofia Salido, Joaquan Altarejos Manuel Nogueras, Adolfo Sanchez, Molbank 2004, M388 Online Publication (页面存档备份,存于互联网档案馆)
- ^ Goren, Mayer B.; Sokoloski, Edward A.; Fales, Henry M. 2-Methyl-(1Z,3E)-butadiene-1,3,4-tricarboxylic Acid, “Isoprenetricarboxylic Acid”. The Journal of Organic Chemistry (American Chemical Society (ACS)). 2005, 70 (18): 7429–7431. ISSN 0022-3263. doi:10.1021/jo0507892.
- ^ Varela, Jesús A.; González-Rodríguez, Carlos; Rubín, Silvia G.; Castedo, Luis; Saá, Carlos. Ru-Catalyzed Cyclization of Terminal Alkynals to Cycloalkenes. Journal of the American Chemical Society (American Chemical Society (ACS)). 2006, 128 (30): 9576–9577. ISSN 0002-7863. doi:10.1021/ja0610434.
- ^ Vashchenko, Valeriy; Kutulya, Lidiya; Krivoshey, Alexander. Simple and Effective Protocol for Claisen-Schmidt Condensation of Hindered Cyclic Ketones with Aromatic Aldehydes. Synthesis (Georg Thieme Verlag KG). 2007-07-03, 2007 (14): 2125–2134. ISSN 0039-7881. doi:10.1055/s-2007-983746.