高铼酸
外观
| 高铼酸 | |
|---|---|

| |

| |
| IUPAC名 铼(VII)酸 | |
| 识别 | |
| CAS号 | 13768-11-1 |
| SMILES |
|
| InChI |
|
| InChIKey | JOTGKJVGIIKFIQ-SEUCOXMMAB |
| RTECS | TT4550000 |
| 性质 | |
| 化学式 | HReO4 |
| 摩尔质量 | 251.215 g·mol⁻¹ |
| 外观 | 黄绿色或土黄色潮解性固体 稀溶液为无色[1] |
| 溶解性(水) | 易溶于水 |
| pKa | -1.25 |
| 危险性 | |
| H-术语 | H302, H314, H332 |
| P-术语 | P260, P261, P264, P270, P271, P280, P301+312, P301+330+331, P303+361+353, P304+312, P304+340, P305+351+338, P310, P312 |
| 相关物质 | |
| 其他阴离子 | 高锰酸 高锝酸 |
| 其他阳离子 | 高铼酸铵 |
| 相关化学品 | 七氧化二铼 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
[编辑]七氧化二铼溶于水,可以得到高铼酸。另外,金属铼或者新沉淀的二氧化铼溶于过氧化氢,也能得到高铼酸。[1]
其溶液的浓缩应该控制在90℃以下,避免分解。[2]
化学性质
[编辑]高铼酸可以和金属氧化物、氢氧化物或碳酸盐作用,产生高铼酸盐:
- Ni(OH)2 + 2 HReO4 → Ni(ReO4)2 + 2 H2O
- NH3 + HReO4 → NH4ReO4
无水高铼酸在真空中65℃即分解。
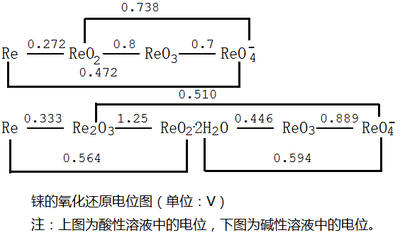
铼的氧化还原电位图如下:
- 2 HReO4 + 7 H2S → Re2S7↓ + 8 H2O
用途
[编辑]高铼酸可以用于制备其他高铼酸盐,也可以用于有机合成中的催化剂。另外,它是制造X射线靶原材料之一。
参考资料
[编辑]- ^ 1.0 1.1 1.2 《无机化学丛书》. 第九卷 锰分族 铁系 铂系. 谢高阳 等主编. 科学出版社. P114~116. 3.13.3 含氧酸及其盐类
- ^ 《无机化合物制备手册》.朱文祥 主编.化学工业出版社.pp310. 【Ⅶ-68】高铼酸(perrhenic acid)
- ^ 《无机化学反应方程式手册》. 曹忠良等主编. P320. 【HReO4】
- ^ Ishihara, K.; Furuya, Y.; Yamamoto, H. Rhenium(VII) Oxo Complexes as Extremely Active Catalysts in the Dehydration of Primary Amides and Aldoximes to Nitriles. Angewandte Chemie, International Edition. 2002, 41 (16): 2983–2986. doi:10.1002/1521-3773(20020816)41:16<2983::AID-ANIE2983>3.0.CO;2-X.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||