碳-氮键
外观
(重定向自碳-氮键)
碳-氮键是碳原子和氮原子之间形成的共价键,它也是有机化学和生物化学中最常见的化学键之一。[1]
氮原子有五个价电子,在通常的胺中的化合价为3,剩下的两个电子形成一对孤对电子。通过那对电子,氮可以与氢形成配位键使自身的配位数达到4,并形成带有一个正电荷的铵盐。许多氮化合物因此具有碱性,但强弱取决于结构:酰胺中的氮原子不具碱性,这是由于其孤对电子离域而与羰基形成共轭效应(类似于羰基的烯醇式),使得N-C键具有部分双键的性质。在吡咯中孤对电子成为6电子芳香共轭体系的一部分因而其氮原子也不具碱性。
与碳-碳键类似,碳氮之间也可以形成稳定的双键,例如亚胺,而腈中还存在三键。键长随着键级的增加而缩短,从胺的147.9pm到C-N= 化合物(例如硝基甲烷)的147.5 pm,吡啶中的部分双键长度为135.2pm,到腈中三键的长度为115.8 pm[2]
CN键是具有强烈极性的共价键(碳和氮电负性分别是2.55和3.04),导致分子偶极矩较高:氰胺为4.27D,重氮甲烷为1.5 D,叠氮甲烷为2.17,吡啶为2.19。因为这个原因许多含有CN键的化合物可溶于水。
含氮官能团
[编辑]| 化学分类 | 键级 | 结构简式 | 结构式 | 例子 | C–N键平均键长(Å)[3] |
|---|---|---|---|---|---|
| 胺 | 1 | R2C-NH2 | 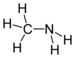 甲胺 |
1.469 (胺) 1.499 (铵盐) | |
| 氮杂环丙烷 | 1 | CH2NHCH2 | 
|
 丝裂霉素C |
1.472 |
| 叠氮化合物 | 1 | R2C-N3 |  叠氮苯 |
||
| 苯胺 | 1 | Ph-NH2 | 
|
 氨基苯甲醚 |
1.355 (sp2 N) 1.395 (sp3 N) 1.465 (铵盐) |
| 吡咯 | 1 | 
|
 卟啉 |
1.372 | |
| 酰胺 | 1.2 | R-CO-NR2 | 
|
 乙酰胺 |
1.325 (一级) 1.334 (二级) 1.346 (三级) |
| 吡啶 | 1.5 | pyr | 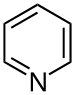
|
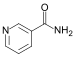 烟酰胺 |
1.337 |
| 亚胺 | 2 | R2C=NR | 
|
 1,5-二氮杂二环[4.3.0]壬-5-烯 |
1.279 (C=N bond) 1.465 (C–N bond) |
| 腈 | 3 | R-CN |  苯甲腈 |
1.136 | |
| 异腈 | 3 | R-NC | 对甲苯磺酰甲基异腈(TOSMIC) |
参见
[编辑]参考资料
[编辑]- ^ Organic Chemistry John McMurry 2nd Ed.
- ^ CRC Handbook of Chemistry and Physics 65Th Ed.
- ^ F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.
