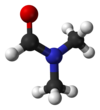
二甲基甲酰胺
| N,N-二甲基甲酰胺 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 N,N-二甲基甲酰胺 | |||
| 别名 | N,N-二甲基甲酰胺 DMF DMFA | ||
| 识别 | |||
| CAS号 | 68-12-2 | ||
| SMILES |
| ||
| RTECS | LQ2100000 | ||
| 性质 | |||
| 化学式 | C3H7NO | ||
| 摩尔质量 | 73.09 g·mol⁻¹ | ||
| 外观 | 透明无色液体 | ||
| 密度 | 0.944 g/cm3,液体 | ||
| 熔点 | −61 °C(−78 °F;212 K) | ||
| 沸点 | 153 °C(307 °F;426 K) | ||
| 溶解性(水) | 无限混溶 | ||
| 折光度n D |
1.4305 (20 °C), εr = 36.71 (25°C) | ||
| 黏度 | 0.92 cP(20 °C) | ||
| 结构 | |||
| 偶极矩 | 3.86 D D (25 °C) | ||
| 危险性 | |||
| 欧盟危险性符号 | |||
| 警示术语 | R:R61-R20/21-R36 | ||
| 安全术语 | S:S53-S45 | ||
| MSDS | ScienceLab.com | ||
| 主要危害 | 易燃 | ||
| NFPA 704 | |||
| 闪点 | 58 °C(136 °F;331 K) | ||
| 相关物质 | |||
| 相关酰胺 | 乙酰胺 甲酰胺 六甲基磷酰胺 | ||
| 相关化学品 | 二甲基亚砜 乙腈 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
二甲基甲酰胺(英语:Dimethylformamide,缩写DMF)是一种能和水及大部分有机溶剂互溶的透明液体。它是化学反应的常用溶剂。纯二甲基甲酰胺是没有气味的,但工业级或变质的二甲基甲酰胺则有鱼腥味,因其含有二甲基胺的不纯物。名称来源是由于它是甲酰胺(甲酸的酰胺)的二甲基取代物,而二个甲基都位于N(氮)原子上。
二甲基甲酰胺是高沸点的极性(亲水性)非质子性溶剂,能促进SN2反应机构的进行。 二甲基甲酰胺是利用甲酸和二甲基胺制造的。二甲基甲酰胺在强碱如氢氧化钠或强酸如盐酸或硫酸的存在下是不稳定的(尤其在高温下),并水解为甲酸与二甲基胺。
用途
[编辑]N,N-二甲基甲酰胺主要用作一低挥发性的溶剂。N,N-二甲基甲酰胺被用于聚丙烯腈纤维及塑料的制造上。在制药工业中,它也用于制造杀虫剂、接著剂、人造皮革、纤维、软片及表面涂装等。[1]
N,N-二甲基甲酰胺是Bouveault醛合成反应及Vilsmeier-Haack反应(另一有用的醛类合成反应)的试剂。[2]它也可在反应中用作氰基、甲酰基、二甲氨基、二甲氨基甲基、二甲氨基羰基、羰基或甲酸根的提供者。[3]
在核磁共振光谱中,N,N-二甲基甲酰胺的甲基上的质子形成二个单峰,因为在核磁共振的时间尺度中,羰基碳-氮键的旋转速率很慢。羰基碳-氮键的键级大于一,而酰胺碳-氧键的键级则小于二。酰胺的红外线光谱中,C=O带通常在小于1700cm−1处,因其C=O键因为从氮供给氧的电子密度而减弱。
N,N-二甲基甲酰胺会渗透大部分的塑料并使其膨胀,故常用作油漆清除剂的成分之一。
安全
[编辑]在二甲基甲酰胺中使用氢化钠进行反应具有一定的危险性。有报导指出在26°C的低温下,仍发生放热的分解反应。在实验室规模中,任何热量的释放(通常)很快会被发现并使用冰浴加以控制,因此二甲基甲酰胺与氢化钠的组合仍十分常用。然而,在试验工厂规模下曾有许多事故发生。
毒性
[编辑]二甲基甲酰胺黏稠而难以蒸发,是十分令人烦恼的溶剂,在许多反应中,可用二甲基亚砜来代替。许多制造商在安全资料表中,将N,N-二甲基甲酰胺的健康危害列为(终身)或(慢性),因为二甲基甲酰胺不太容易被人体排出。
根据国际癌症研究机构(IARC),N,N-二甲基甲酰胺是2A类致癌物。[4]二甲基甲酰胺(DMF)经各种途径吸收后,主要由肝内代谢,排泄较快,主要目标器官为肝脏 ,肾脏也有一定损害。主要经肝内微粒体混合功能氧化酶进行脱甲基化作用,脱去一个甲基,代谢产物为一甲基甲酰胺和甲酰胺,代谢迅速;甲酰胺在血中滞留稍长,进而代谢为甲酸和氨排出。部分二甲基甲酰胺以原形物从尿和呼气排出。
防护措施
[编辑]呼吸制度防护: 氧气中纯度超标时,佩戴自吸净化式防毒面具。佩戴氧气呼吸器。眼睛防护: 戴化工安全防护眼镜。身上防护: 穿防静电工作。手防护: 戴橡胶手套。其他: 工作现场严禁抽烟、进食和饮水。工作完毕,淋浴更衣。
参考资料
[编辑]- ^ Redlich, C; Beckett, W. S.; Sparer, J.; Barwick, K. W.; Riely, C. A.; Miller, H.; Sigal, S. L.; Shalat, S. L.; and Cullen, M. R.; 1988. Liver disease associated with occupational exposure to the solvent dimethylformamide. Ann. Intern. Med. 108:680-686.
- ^ Jacques Muzart. N,N-Dimethylformamide: much more than a solvent. Tetrahedron. 2009-10, 65 (40): 8313–8323 [2022-10-05]. doi:10.1016/j.tet.2009.06.091. (原始内容存档于2022-12-23) (英语).
- ^ Shengtao Ding, Ning Jiao. N , N -Dimethylformamide: A Multipurpose Building Block. Angewandte Chemie International Edition. 2012-09-10, 51 (37): 9226–9237 [2022-10-05]. doi:10.1002/anie.201200859. (原始内容存档于2022-10-08) (英语).
- ^ List of Classifications, Agents classified by the IARC Monographs, Volumes 1–124. IARC Monographs on the Evaluation of Risk to Humans. IARC. July 7, 2019 [July 14, 2019]. (原始内容存档于2020-05-20).
外部链接
[编辑]- 二甲基甲酰胺在 有机合成 上的应用
- 简明国际化学品评估文件31: N,N-二甲基甲酰胺(页面存档备份,存于互联网档案馆)
- 二甲基甲酰胺的 物质安全资料表(页面存档备份,存于互联网档案馆)
- 二甲基甲酰胺慢性毒性摘要 (PDF)
- Chemical Book N,N-二甲基甲酰胺(页面存档备份,存于互联网档案馆)