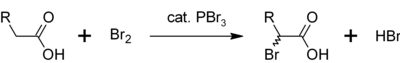三溴化磷
外觀
| 三溴化磷 | |
|---|---|

| |

| |
| IUPAC名 phosphorus tribromide | |
| 別名 | 溴化磷(III) |
| 識別 | |
| CAS號 | 7789-60-8 |
| PubChem | 24614 |
| ChemSpider | 23016 |
| SMILES |
|
| EINECS | 232-178-2 |
| RTECS | TH4460000 |
| 性質 | |
| 化學式 | PBr3 |
| 摩爾質量 | 270.70 g·mol⁻¹ |
| 外觀 | 無色清澈液體 |
| 密度 | 2.852 g/cm3 (液) |
| 熔點 | -41.5 °C (231.7 K) |
| 沸點 | 173.2 °C (446.4 K) |
| 溶解性(水) | 迅速水解 |
| 結構 | |
| 分子構型 | 三角錐 |
| 危險性 | |
| 警示術語 | R:R14, R34, R37 |
| 安全術語 | S:S25, S45 |
| 主要危害 | 腐蝕性,有毒 與水和醇反應 |
| 相關物質 | |
| 其他陰離子 | 三氟化磷、三氯化磷 三碘化磷 |
| 其他陽離子 | 三溴化氮、三溴化砷 三溴化銻 |
| 相關化學品 | 五溴化磷、溴氧化磷 七溴化磷 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
三溴化磷為淡黃色發煙無色液體,有刺激性臭味,具腐蝕性。可溶於丙酮、二硫化碳、氯仿、四氯化碳。目前用於化學分析和有機合成,或作為催化劑。
三溴化磷對眼睛、皮膚、粘膜和呼吸道有強烈的刺激性。人體經呼吸吸入、誤食或皮膚接觸後,會產生燒灼感、咳嗽、喘息、喉炎、氣短、頭痛、噁心和嘔吐。
製備
[編輯]三溴化磷可通過單質磷與溴化合製備,以PBr3自身作溶劑(白磷可溶於其中):
磷要過量,否則會生成五溴化磷。
反應及有機合成應用
[編輯]三溴化磷與水反應,生成溴化氫和亞磷酸,反應激烈時會發生爆炸:
- PBr3 + 3 H2O → H3PO3 + 3 HBr
三溴化磷和三氯化磷、三氟化磷類似,都可作為路易斯酸或路易斯鹼。一方面,它可與三溴化硼生成1:1加合物Br3B-PBr3;另一方面,它也可作為親電試劑與胺反應。
PBr3最常用作轉化醇為溴代烴,分子中的三個溴原子都可溴化:[1]
- PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2
機理涉及SN2親核取代反應,如下圖所示:
由於機理的緣故,該反應只對一級和二級醇起作用,而且反應後α碳發生構型翻轉。
- PBr3 + 3 RCOOH → 3 RCOBr + HP(O)(OH)2
三溴化磷也可用作羧酸α氫溴化反應中的催化劑,製取Hell-Volhard-Zelinsky反應反應物酰溴的前體[2] 以及合成藥物等。
三溴化磷是強還原劑,與氧氣的反應比三氯化磷更加激烈,最終爆炸性生成P2O5和Br2。
參考資料
[編輯]- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.