內源性反轉錄病毒
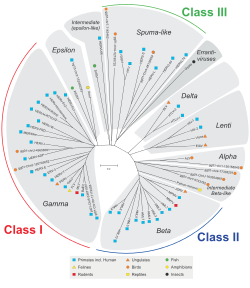
內源性反轉錄病毒(Endogenous retrovirus,簡稱ERV)是脊椎動物基因組中的一類具有長末端重複序列(LTR)的基因元件,與LTR反轉錄轉座子非常相似,但除了gag與pol兩基因外還多了編碼包膜蛋白的env基因,可能源於千萬年前感染細胞的反轉錄病毒,這些反轉錄病毒整合進宿主細胞基因組中,大部分已累積許多突變而不再能組裝成完整病毒顆粒,僅能透過細胞複製垂直傳播而不能在細胞間水平傳播,許多甚至已丟失了開放閱讀框,只剩兩側的LTR[1],不過有些仍能表現病毒蛋白,甚至有能組裝成顆粒感染其他細胞者[2]。細胞中有許多機制可抑制內源性反轉錄病毒的基因表現,但這些序列仍可能在生殖細胞中與發育早期的胚胎裡轉錄,進而複製增殖,內源性反轉錄病毒的過度表現可能與一些癌症與神經退化性疾病有關[3]。
反轉錄病毒丟失env基因後可能轉為LTR反轉錄轉座子,反之LTR反轉錄轉座子獲得env基因後可能轉為反轉錄病毒[4],不過文獻中常見混用兩者的狀況,且許多內源性反轉錄病毒丟失了編碼蛋白的序列,有些LTR反轉錄轉座子新獲得類似env蛋白的序列,使兩者差異更趨模糊[4]。有研究發現內源性反轉錄病毒丟失env基因而轉為反轉錄轉座子後,雖不能作為病毒感染其他細胞,但在基因組中增殖的能力大大增加[5]。
實例
[編輯]人類基因組序列中有約5%至8%為內源性反轉錄病毒[6][7],可分為30至40個基因家族,並可依序列歸為三型,第一型人類內源性反轉錄病毒(HERV)與Γ反轉錄病毒屬和Ε反轉錄病毒屬接近,第二型HERV與Β反轉錄病毒屬接近,第三型HERV則與泡沫反轉錄病毒接近[8]。HERV-K(屬第二型HERV)約在數百萬年前進入靈長類基因組[9],現在人類基因組中約有數百個HERV-K,有些尚有完整的開放閱讀框,在胚胎發育與某些疾病中可生成蛋白質[10][11]。另外還有HERV-T、HERV-L(最古老、存在於許多哺乳類類群中,但無發現env序列)、HERV-H(數量最多的HERV)、HERV-W(env基因被細胞用來編碼合胞素-1)[12]。小鼠基因組中的內源性反轉錄病毒則包括與小鼠白血病病毒相關的元件、與鼠乳腺癌病毒相關的元件(如IAP元件)、MusD2/ETn元件和MuERV-L元件等[13]。豬基因組的內源性反轉錄病毒(porcine endogenous retroviruses,PERV)分為PERVA、PERVB與PERVC三型,其中有些可能仍保有組成病毒顆粒以感染其他細胞的能力[14],為過去進行異種器官移植(將豬的器官移植到病人身上)的一項隱憂,2017年有研究人員成功以CRISPR將豬基因組中所有內源性反轉錄病毒都去活化,以避免它們跨物種感染病患[15]。
影響基因表現
[編輯]有些內源性反轉錄病毒和LTR反轉錄轉座子被細胞用作調控自身基因表現的一種方式[16][17]。LTR序列插入基因的5'後可能被用作啟動子或強化子影響基因表現,在某些案例中甚至可影響下游約70kb處基因的表現[18][19]。人類AMY1C基因的啟動子中即有完整的內源性反轉錄病毒序列,可調控其在唾腺的表現[20];BAAT基因主要的啟動子也是來自內源性反轉錄病毒的LTR[21]。有些案例中,內源性反轉錄病毒的序列成為基因新的啟動子,進而影響基因表現的組織種類,生殖組織中即有許多此類案例[22],例如編碼芳香化酶的CYP19基因在大部分哺乳類中表現於腦部與生殖器官,但在靈長類中,因內源性反轉錄病毒LTR的插入而可在胎盤細胞中轉錄出一個5端序列卻有差異的mRNA(transcript variant),進而在胎盤中表現蛋白,影響懷孕時雌激素的水平[19]。NOS3、IL2RB和HSD17B1也都由啟動子的LTR序列調控其在胎盤的表現[21][23],這些現象顯示LTR可能可與胎盤表現的轉錄因子結合,也能是胎盤DNA缺乏甲基化而不抑制其表現所致[24]。另外有假說認為胚胎中深入胎盤的滋胚層細胞可能利用內源性反轉錄病毒抑制母體的免疫反應,以避免受到母體免疫細胞的攻擊,此機制可能對胎生的演化相當重要[25]。
除了影響基因表現,內源性反轉錄病毒還可能與宿主DNA重組成新的基因,例如新大陸猴與舊大陸猴的IRGM基因開放閱讀框因Alu元件的插入而被破壞,使其成為不能編碼蛋白的偽基因,但在大猩猩等人科動物基因組中,內源性反轉錄病毒ERV9的插入將其開放閱讀框恢復,使其可編碼蛋白[26];人類的內源性反轉錄病毒HERV-W雖已不具完整序列,但其env基因被細胞用來編碼合胞素1,在胚胎的合胞體滋胚層(胎盤外層入侵子宮內膜的細胞)中表現。
參考文獻
[編輯]- ^ Ishak, Charles A.; De Carvalho, Daniel D. Reactivation of Endogenous Retroelements in Cancer Development and Therapy. Annual Review of Cancer Biology. 2020, 4: 159–176. doi:10.1146/annurev-cancerbio-030419-033525.
- ^ van der Laan LJ, Lockey C, Griffeth BC, Frasier FS, Wilson CA, Onions DE; et al. Infection by porcine endogenous retrovirus after islet xenotransplantation in SCID mice.. Nature. 2000, 407 (6800): 90–4. PMID 10993079. doi:10.1038/35024089.
- ^ Meyer TJ, Rosenkrantz JL, Carbone L, Chavez SL. Endogenous Retroviruses: With Us and against Us.. Front Chem. 2017, 5: 23. PMC 5384584
 . PMID 28439515. doi:10.3389/fchem.2017.00023.
. PMID 28439515. doi:10.3389/fchem.2017.00023.
- ^ 4.0 4.1 Hayward A. Origin of the retroviruses: when, where, and how?. Curr Opin Virol. 2017, 25: 23–27. PMC 5962544
 . PMID 28672160. doi:10.1016/j.coviro.2017.06.006.
. PMID 28672160. doi:10.1016/j.coviro.2017.06.006.
- ^ Magiorkinis G, Gifford RJ, Katzourakis A, De Ranter J, Belshaw R. Env-less endogenous retroviruses are genomic superspreaders.. Proc Natl Acad Sci U S A. 2012, 109 (19): 7385–90. PMC 3358877
 . PMID 22529376. doi:10.1073/pnas.1200913109.
. PMID 22529376. doi:10.1073/pnas.1200913109.
- ^ Belshaw R, Pereira V, Katzourakis A, Talbot G, Paces J, Burt A, Tristem M. Long-term reinfection of the human genome by endogenous retroviruses. Proc Natl Acad Sci USA. April 2004, 101 (14): 4894–99. Bibcode:2004PNAS..101.4894B. PMC 387345
 . PMID 15044706. doi:10.1073/pnas.0307800101.
. PMID 15044706. doi:10.1073/pnas.0307800101.
- ^ Nelson PN, Hooley P, Roden D, Davari Ejtehadi H, Rylance P, Warren P, et al. Human endogenous retroviruses: transposable elements with potential?. Clinical and Experimental Immunology. October 2004, 138 (1): 1–9. PMC 1809191
 . PMID 15373898. doi:10.1111/j.1365-2249.2004.02592.x.
. PMID 15373898. doi:10.1111/j.1365-2249.2004.02592.x.
- ^ Vargiu L, Rodriguez-Tomé P, Sperber GO, Cadeddu M, Grandi N, Blikstad V; et al. Classification and characterization of human endogenous retroviruses; mosaic forms are common.. Retrovirology. 2016, 13: 7. PMC 4724089
 . PMID 26800882. doi:10.1186/s12977-015-0232-y.
. PMID 26800882. doi:10.1186/s12977-015-0232-y.
- ^ Barbulescu M, Turner G, Seaman MI, Deinard AS, Kidd KK, Lenz J. Many human endogenous retrovirus K (HERV-K) proviruses are unique to humans.. Curr Biol. 1999, 9 (16): 861–8. PMID 10469592. doi:10.1016/s0960-9822(99)80390-x.
- ^ Wildschutte JH, Williams ZH, Montesion M, Subramanian RP, Kidd JM, Coffin JM. Discovery of unfixed endogenous retrovirus insertions in diverse human populations.. Proc Natl Acad Sci U S A. 2016, 113 (16): E2326–34. PMC 4843416
 . PMID 27001843. doi:10.1073/pnas.1602336113.
. PMID 27001843. doi:10.1073/pnas.1602336113.
- ^ Grow EJ, Flynn RA, Chavez SL, Bayless NL, Wossidlo M, Wesche DJ; et al. Intrinsic retroviral reactivation in human preimplantation embryos and pluripotent cells.. Nature. 2015, 522 (7555): 221–5. PMC 4503379
 . PMID 25896322. doi:10.1038/nature14308.
. PMID 25896322. doi:10.1038/nature14308.
- ^ Magiorkinis G, Belshaw R, Katzourakis A. 'There and back again': revisiting the pathophysiological roles of human endogenous retroviruses in the post-genomic era.. Philos Trans R Soc Lond B Biol Sci. 2013, 368 (1626): 20120504. PMC 3758188
 . PMID 23938753. doi:10.1098/rstb.2012.0504.
. PMID 23938753. doi:10.1098/rstb.2012.0504.
- ^ McCarthy EM, McDonald JF. Long terminal repeat retrotransposons of Mus musculus.. Genome Biol. 2004, 5 (3): R14. PMC 395764
 . PMID 15003117. doi:10.1186/gb-2004-5-3-r14.
. PMID 15003117. doi:10.1186/gb-2004-5-3-r14.
- ^ Patience C, Takeuchi Y, Weiss RA. Infection of human cells by an endogenous retrovirus of pigs. Nature Medicine. March 1997, 3 (3): 282–86. PMID 9055854. doi:10.1038/nm0397-282.
- ^ Niu D, Wei HJ, Lin L, George H, Wang T, Lee IH, Zhao HY, Wang Y, Kan Y, Shrock E, Lesha E, Wang G, Luo Y, Qing Y, Jiao D, Zhao H, Zhou X, Wang S, Wei H, Güell M, Church GM, Yang L. Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science. September 2017, 357 (6357): 1303–07. Bibcode:2017Sci...357.1303N. PMC 5813284
 . PMID 28798043. doi:10.1126/science.aan4187.
. PMID 28798043. doi:10.1126/science.aan4187.
- ^ Khodosevich K, Lebedev Y, Sverdlov E. Endogenous retroviruses and human evolution. Comparative and Functional Genomics. October 2002, 3 (6): 494–98. PMC 2448423
 . PMID 18629260. doi:10.1002/cfg.216.
. PMID 18629260. doi:10.1002/cfg.216.
- ^ Kim FJ, Battini JL, Manel N, Sitbon M. Emergence of vertebrate retroviruses and envelope capture. Virology. January 2004, 318 (1): 183–91. PMID 14972546. doi:10.1016/j.virol.2003.09.026.
- ^ Pi W, Zhu X, Wu M, Wang Y, Fulzele S, Eroglu A, Ling J, Tuan D. Long-range function of an intergenic retrotransposon. PNAS. July 2010, 107 (29): 12992–97. Bibcode:2010PNAS..10712992P. PMC 2919959
 . PMID 20615953. doi:10.1073/pnas.1004139107.
. PMID 20615953. doi:10.1073/pnas.1004139107.
- ^ 19.0 19.1 van de Lagemaat LN, Landry JR, Mager DL, Medstrand P. Transposable elements in mammals promote regulatory variation and diversification of genes with specialized functions. Trends Genet. October 2003, 19 (10): 530–36. PMID 14550626. doi:10.1016/j.tig.2003.08.004.
- ^ Ting CN, Rosenberg MP, Snow CM, Samuelson LC, Meisler MH. Endogenous retroviral sequences are required for tissue-specific expression of a human salivary amylase gene. Genes Dev. 1992, 6 (8): 1457–65. PMID 1379564. doi:10.1101/gad.6.8.1457.
- ^ 21.0 21.1 Cohen CJ, Lock WM, Mager DL. Endogenous retroviral LTRs as promoters for human genes: a critical assessment. Gene. 2009, 448 (2): 105–14. PMID 19577618. doi:10.1016/j.gene.2009.06.020.
- ^ Oliver KR, Greene WK. Mobile DNA and the TE-Thrust hypothesis: supporting evidence from the primates. Mob DNA. 2011, 2 (1): 8. PMC 3123540
 . PMID 21627776. doi:10.1186/1759-8753-2-8.
. PMID 21627776. doi:10.1186/1759-8753-2-8.
- ^ Huh JW, Ha HS, Kim DS, Kim HS. Placenta-restricted expression of LTR-derived NOS3.. Placenta. 2008, 29 (7): 602–8. PMID 18474398. doi:10.1016/j.placenta.2008.04.002.
- ^ Cohen CJ, Lock WM, Mager DL. Endogenous retroviral LTRs as promoters for human genes: a critical assessment.. Gene. 2009, 448 (2): 105–14. PMID 19577618. doi:10.1016/j.gene.2009.06.020.
- ^ Villarreal LP, Villareal LP. On viruses, sex, and motherhood.. J Virol. 1997, 71 (2): 859–65. PMC 191132
 . PMID 8995601. doi:10.1128/JVI.71.2.859-865.1997.
. PMID 8995601. doi:10.1128/JVI.71.2.859-865.1997.
- ^ Bekpen C, Marques-Bonet T, Alkan C, Antonacci F, Leogrande MB, Ventura M; et al. Death and resurrection of the human IRGM gene.. PLoS Genet. 2009, 5 (3): e1000403. PMC 2644816
 . PMID 19266026. doi:10.1371/journal.pgen.1000403.
. PMID 19266026. doi:10.1371/journal.pgen.1000403.
