高鐵酸鋇
| 高鐵酸鋇 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Barium ferrate(VI) 鐵(VI)酸鋇 | |||
| 別名 | 鐵酸鋇 | ||
| 識別 | |||
| CAS號 | 13773-23-4 | ||
| SMILES |
| ||
| 性質 | |||
| 化學式 | BaFeO4 | ||
| 摩爾質量 | 257.1646 g·mol⁻¹ | ||
| 外觀 | 深紅色晶體 | ||
| 溶解性(水) | 不溶 | ||
| 結構 | |||
| 晶體結構 | 正交晶系 | ||
| 空間群 | Pnma, No. 62[1] | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
高鐵酸鋇是一種無機化合物,化學式 BaFeO4。它是一種罕見的六價鐵化合物。[2] 其中的鐵(VI)酸根離子有兩個不成對電子,所以是順磁性的。[3]它的結構類似BaSO4,含有四面體型的[FeO4]2− 陰離子。[4]
結構[編輯]
其中的高鐵酸根陰離子是順磁性的,因為它有兩個不成對電子,而且是四面體形分子構型的。[3]
X射線晶體學顯示BaFeO4 納米晶是正交晶系的[1](晶格參數 a ≠ b ≠ c,α=β=γ=90°)[5]。它的空間群為 Pnma,晶格參數 a = 0.8880 nm、b = 0.5512 nm 和c = 0.7214 nm。[1]

表徵[編輯]
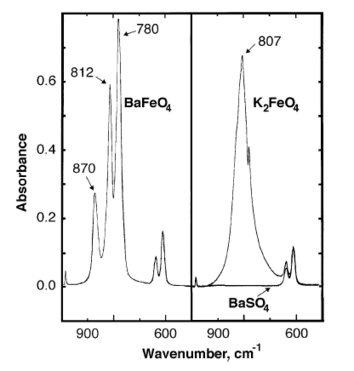
在 870、812、780 cm−1處都觀察到高鐵酸鋇的紅外吸收峰。[7]
BaFeO4 遵守居里-外斯定律,磁矩為 (2.92 ± 0.03) × 10−23 A m2 (3.45 ± 0.1 BM),外斯參數為 −89 K。[9]
製備和反應[編輯]
高鐵酸鋇可以通過干法或濕法製備。干法合成通常會加熱,[7]例如氫氧化鋇和氫氧化亞鐵在氧氣存在下加熱到 800 至 900 °C而成。[10]
- Ba(OH)
2 + Fe(OH)
2 + O
2 → BaFeO
4 + 2 H
2O
濕法則採用化學和電化學技術。舉個例子,當將氫氧化鐵置於鹼性條件下並加入強氧化劑(如次氯酸鈉)時,就會形成高鐵酸根陰離子。[11]
- 2 Fe(OH)
3 + 3 OCl−
+ 4 OH−
→ 2 FeO2−
4 + 5 H
2O + 3 Cl−
在溶液中加入鋇鹽,得到高鐵酸鋇沉澱。[11]將可溶的鋇鹽加入到鹼金屬高鐵酸鹽溶液中,會產生深紅色的高鐵酸鋇沉澱。這種晶體有和鉻酸鋇一樣的結構,溶解度也差不多。[12]高鐵酸鋇也可以由氧化鋇加到次氯酸鈉和硝酸鐵的混合物中而成。[13]通過在沒有二氧化碳的情況下低溫進行反應,並通過快速過濾和乾燥沉澱物,減少氫氧化鋇和碳酸鋇作為雜質共沉澱,可以提高產品的純度。[12]
用處[編輯]
高鐵酸鋇是一種氧化劑,可用於有機合成。它也用於脫色、去除氰化物、殺滅細菌以及污染和廢水的處理。[7]
高鐵酸鹽可作為「超級鐵」電池的高能陰極材料。含有高鐵酸鹽的陰極因為高度氧化、多電子轉移和高內能,而被稱為「超級鐵」陰極。在所有高鐵酸鹽中,高鐵酸鋇的電荷轉移異常容易,這對於鹼性電池的高功率領域很重要。[8]
參見[編輯]
參考資料[編輯]
- ^ 1.0 1.1 1.2 Ni, Xiao-Min; Ji, Ming-Rong; Yang, Zhi-Ping; Zheng, Hua-Gui. Preparation and structure characterization of nanocrystalline BaFeO4. Journal of Crystal Growth. 2004, 261 (1): 82–86. doi:10.1016/j.jcrysgro.2003.09.024.
- ^ Briggs, J. G. R. Longman A-level course in chemistry 4th. Pearson Education South Asia. 2005: 536. ISBN 978-981-4105-08-8.
- ^ 3.0 3.1 Wiberg, Egon; Wiberg, Nils; Holleman, Arnold. Inorganic chemistry. Academic Press. 2001: 1457–1458. ISBN 978-0-12-352651-9.
- ^ Wells, A.F. Structural inorganic chemistry 5th. Oxford [Oxfordshire]: Clarendon Press. 1986. ISBN 978-0-19-855370-0.
- ^ IUCr. www.iucr.org. [2016-04-29]. (原始內容存檔於2021-07-21).
- ^ Ropp, Richard C. Encyclopedia of the Alkaline Earth Compounds. Newnes Press. 2012 [2021-07-21]. ISBN 9780444595539. (原始內容存檔於2021-08-24).
- ^ 7.0 7.1 7.2 Henry-Chase, Adonica; Bhushan Tewari, Brij. Use to Ferrate (VI) A Green Chemical for the Environment Remediation (PDF). Revista Boliviana de Química. 2013, 30 (1): 13–23 [2021-07-21]. ISSN 0250-5460. (原始內容存檔 (PDF)於2019-11-04).
- ^ 8.0 8.1 Licht, Stuart; Naschitz, Vera; Wang, Baohui. Rapid chemical synthesis of the barium ferrate super-iron Fe (VI) compound, BaFeO4. Journal of Power Sources. 2002, 109: 67–70. doi:10.1016/s0378-7753(02)00041-1.
- ^ Audette, R. J.; Quail, J. W. Potassium, rubidium, cesium, and barium ferrates(VI). Preparations, infrared spectra, and magnetic susceptibilities. Inorganic Chemistry. 1972, 11 (8): 1904–1908. doi:10.1021/ic50114a034.
- ^ Sharma, R. K. Stabilisation of Fe (VI). Textbook of Coordination Chemistry. New Delhi: Discovery Publishing House. 2007: 124 [2021-07-21]. ISBN 9788183562232. (原始內容存檔於2021-07-21).
- ^ 11.0 11.1 Wulfsberg, Gary. pH and the stability of high oxidation states; Syntheses of oxo anions and their use as oxidizing agents. Principles of Descriptive Inorganic Chemistry. Sausalito, CA: University Science Books. 1991: 142–143 [2021-07-21]. ISBN 9780935702668. (原始內容存檔於2021-07-21).
- ^ 12.0 12.1 Gump, J. R.; Wagner, W. F.; Schreyer, J. M. Preparation and analysis of barium ferrate(VI). Analytical Chemistry. 1954, 26 (12): 1957. ISSN 0003-2700. doi:10.1021/ac60096a027.
- ^ Herber, Rolfe H.; Johnson, David. Lattice dynamics and hyperfine interactions in M2FeO4 (M = K+, Rb+, Cs+) and M'FeO4 (M' = Sr2+, Ba2+). Inorganic Chemistry. 1979, 18 (10): 2786–2790. doi:10.1021/ic50200a030.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||


