氯金酸
外观
| 氯金酸 | |
|---|---|
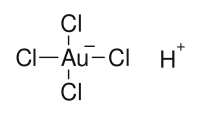
| |

| |
| 别名 | 四氯合金酸 |
| 识别 | |
| CAS号 | 16903-35-8 |
| ChemSpider | 26171 |
| SMILES |
|
| InChI |
|
| InChIKey | IXPWAPCEBHEFOV-ACHCXQQJAP |
| 性质 | |
| 化学式 | HAuCl4 |
| 摩尔质量 | 339.785 g/mol (无水) 393.833 g/mol (三水) 411.85 g/mol (四水) g·mol⁻¹ |
| 外观 | 金黄色晶体 潮解 |
| 密度 | 3.9 g/cm3 (四水) |
| 熔点 | 254°C |
| 溶解性(水) | 可溶 |
| 溶解性 | 可溶于乙醇、乙醚 |
| 危险性 | |
| 欧盟危险性符号 [1] | |
| 警示术语 | R:R22, R36, R37, R38[1] |
| MSDS | JT Baker |
| 欧盟分类 | 未列出 |
| NFPA 704 | |
| 相关物质 | |
| 其他阴离子 | 溴金酸 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氯金酸也称为四氯合金酸,是分子式为H[AuCl4]的无机化合物。
制备及结构
[编辑]- Au + HNO3 + 4 HCl → H[AuCl4] + NO↑ + 2 H2O
加热时,氯金酸会分解为氯化氢及三氯化金,此反应是可逆反应,因此将三氯化金溶解在盐酸中也可产生氯金酸。
- AuCl3 + HCl⇌H[AuCl4]
氯金酸水溶液中含有正方平面的[AuCl4]−离子,常用来制备其他含金的配合物[3]。
化学性质
[编辑]氯金酸会被大部分的金属所还原,还原反应的速度很快,还原后的产物是元素态的金。
氯金酸能够表现出较强的氧化性。
氯金酸被二甲硫醚还原后会生成二甲硫醚氯化亚金,也常用来生成其他的含金配合物[4]。
氯金酸和氨或铵盐反应,可以得到灰色且具有强爆炸性的“雷金”,它被认为是Au2O3·3NH3和HNAuCl·NH3的混合物。过量氨和这种混合物反应,产生Au(OH)3·3NH3,用热水处理得到Au2O3·2NH3。[5]
应用
[编辑]胶体金及金的纳米颗粒一般可由柠檬酸钠还原氯金酸溶液来制备,也可用其他的程序来制备奈米金,例如烫金过程使用的Norrish反应及乙醛还原反应[6]。
参考资料
[编辑]- ^ 1.0 1.1 MSDS of Chloroauric Acid
- ^ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 1057.
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Marie-Claude Brandys , Michael C. Jennings and Richard J. Puddephatt. Luminescent gold(I) macrocycles with diphosphine and 4,4-bipyridyl ligands. J. Chem. Soc., Dalton Trans. 2000, (24): 4601–4606. doi:10.1039/b005251p.
- ^ 钟兴厚 等. 无机化学丛书 第六卷 卤素 铜分族 锌分族. 科学出版社,2012.3. pp 468. 3.6.7 氮化物、叠氮化物、硝酸盐、磷化物和砷酸盐
- ^ Facile Photochemical Synthesis of Unprotected Aqueous Gold Nanoparticles Katherine L. McGilvray, Matthew R. Decan, Dashan Wang, and Juan C. Scaiano, J. Am. Chem. Soc.; 2006; 128(50) pp 15980 - 15981; (Communication) doi:10.1021/ja066522h
拓展阅读
[编辑]- Explosive Gold - Explosionandfire (页面存档备份,存于互联网档案馆)(视频). 氯金酸和氨水反应


