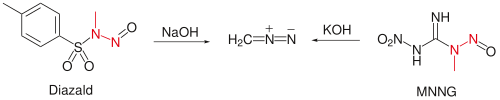重氮甲烷
外观
| 重氮甲烷 | |
|---|---|

| |

| |
| IUPAC名 Diazomethane | |
| 识别 | |
| CAS号 | 334-88-3 |
| PubChem | 9550 |
| ChemSpider | 9176 |
| SMILES |
|
| InChI |
|
| InChIKey | YXHKONLOYHBTNS-UHFFFAOYAZ |
| ChEBI | 73716 |
| KEGG | C19387 |
| 性质 | |
| 化学式 | CH2N2 |
| 摩尔质量 | 42.04 g·mol⁻¹ |
| 密度 | 1.45 g·cm−3[1] |
| 熔点 | −145 °C[1] |
| 沸点 | −23 °C[1] |
| 溶解性(水) | 分解[1] |
| 溶解性 | 可溶于乙醇、乙醚和苯[2] |
| 结构 | |
| 分子构型 | 直线形C=N=N骨架 |
| 偶极矩 | 极性 |
| 危险性 | |
| 警示术语 | R:R12, R19, R22, R66, R67 |
| 安全术语 | S:S9, S16, S29, S33 |
| 主要危害 | 有毒、爆炸性 |
| 相关物质 | |
| 相关官能团 | 叠氮化物 R-N=N=N 偶氮化合物 R-N=N-R |
| 相关化学品 | R2CN2 R = Ph、TMS、CF3 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
重氮甲烷是最简单的重氮化合物,化学式为CH2N2,由德国化学家汉斯·冯·佩希曼于1894年发现。它在室温下是不稳定的黄色有毒气体,具爆炸性,因此一般均使用它的乙醚溶液。它是实验室常见的甲基化试剂,但因为在工业上太危险[3]而被更安全的三甲基硅基重氮甲烷取代了。[4]
制备
[编辑]实验室中制取的重氮甲烷的量通常以mmol计,方法是用N-甲基-N-亚硝基对甲苯磺酰胺(Diazald)的二乙二醇二甲醚和乙醚溶液与温热的氢氧化钠水溶液反应,蒸馏提纯;[5] 或以1-甲基-3-硝基-1-亚硝基胍(MNNG)为原料,低温加入氢氧化钾水溶液也可得到重氮甲烷。
反应
[编辑]一般使用的是重氮甲烷的乙醚溶液。它可以进行的反应有:
检验
[编辑]重氮甲烷的含量可通过两种方法获得:一是与一定量且过量的苯甲酸在冷乙醚中反应,剩余的苯甲酸用基准氢氧化钠滴定;二是用分光光度法分析重氮甲烷的乙醚溶液,其在410nm处的消光系数为7.2。[來源請求]
相关化合物
[编辑]很多重氮甲烷的衍生物也已制得:
- 两个三氟甲基取代的(CF3)2CN2(沸点为12–13 °C)。[7]
- 两个苯基取代的Ph2CN2(熔点29–30 °C)。[8]
- 三甲硅基取代的(CH3)3SiCHN2,已有出售,甲基化效果与重氮甲烷相当。[9]
- 一个苯基取代的PhC(H)N2,红色液体,0.1mmHg时的沸点小于25 °C。[10]
安全
[编辑]吸入重氮甲烷,及皮肤或眼部接触重氮甲烷都是有毒的(TLV 0.2ppm),症状包括心脏不适、头痛、身体虚弱、体力不支,严重时会致人昏倒。[11] 重氮甲烷与磨砂玻璃的接口接触,或加热至100 °C都可能会发生爆炸,使用时必须小心,避免以上材料的使用。
参考资料
[编辑]- ^ 1.0 1.1 1.2 1.3 Record of Diazomethan in the GESTIS Substance Database from the IFA.
- ^ Hans Beyer, Wolfgang Walter, Wittko Francke: Lehrbuch der Organischen Chemie. 23. Auflage. S. Hirzel Verlag 1998, ISBN 3-7776-0808-4.
- ^ Proctor, Lee D.; Warr, Antony J. Development of a Continuous Process for the Industrial Generation of Diazomethane. Organic Process Research & Development. November 2002, 6 (6): 884–892. doi:10.1021/op020049k.
- ^ Shioiri, Takayuki; Aoyama, Toyohiko; Snowden, Timothy. Encyclopedia of Reagents for Organic Synthesis. e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001. ISBN 0471936235. doi:10.1002/047084289X.rt298.pub2.
|chapter=被忽略 (帮助) - ^ J. A. Moore, D. E. Reed. "Diazomethane[永久失效連結]". Organic Syntheses Col. Vol. 5, page 351.
- ^ P. G. Gassman, W. J. Greenlee. "Dideuterodiazomethane[永久失效連結]". Organic Syntheses Col. Vol. 6, page 432.
- ^ W. J. Middleton, D. M. Gale. "Bis(Trifluoromethyl))diazomethane[永久失效連結]". Organic Syntheses Col. Vol. 6, page 161.
- ^ L. I. Smith, K. L. Howard. "Diphenyldiazomethane[永久失效連結]". Organic Syntheses Col. Vol. 3, page 351.
- ^ T. Shioiri, T. Aoyama, S. Mori. "Trimethylsilyldiazomethane[永久失效連結]". Organic Syntheses Col. Vol. 8, page 612.
- ^ X. Creary. "Tosylhydrazone Salt Pyrolyses: Phenydiazomethanes (页面存档备份,存于互联网档案馆)". Organic Syntheses Col. Vol. 7, p.438 (1990).; Vol. 64, p.207 (1986).
- ^ Muir, GD (ed.) 1971, Hazards in the Chemical Laboratory, The Royal Institute of Chemistry, London.