乙炔二醇
| 乙炔二醇 | |
|---|---|
| |
| IUPAC名 Ethynediol | |
| 英文名 | Acetylenediol |
| 別名 | Dihydroxyacetylene |
| 識別 | |
| CAS號 | |
| PubChem | 9942115 |
| ChemSpider | 8117727 |
| SMILES |
|
| InChI |
|
| InChIKey | ZUQAPLKKNAQJAU-UHFFFAOYAS |
| 性質 | |
| 化學式 | C2H2O2 |
| 莫耳質量 | 58.07 g·mol⁻¹ |
| 沸點 | 分解 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
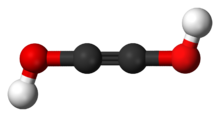
乙炔二醇(英語:Acetylenediol)是一種有機化合物,其結構式為HO-C≡C-OH。它是具有二醇結構的乙炔衍生物。高濃度的乙炔二醇很不穩定,會異構化成為乙二醛 H(C=O)2H。
檢測與發現[編輯]
1986年J. K. Terlouw使用質譜分析金屬有機化合物還原後的氣態產物時發現了乙炔二醇。[1]
1995年,Günther Maier和Christine Rohr在10K溫度下於固態的氬當中光解方酸獲得了乙炔二醇。[2]
衍生物[編輯]
烷氧基衍生物[編輯]
雖然炔醇這種結構異常不穩定,而它的鹽乙炔二醇鹽負離子(O-C≡C-O)2− 還是早已被熟知的。這些有機金屬化合物(尤其是醇鹽化合物)通常由二醇類的物質和活潑金屬作用失去氫離子來獲得,但是這裡介紹的乙炔二醇鹽卻並非通過這種常規手段獲得。
通常合成乙炔二醇鹽的方法是通過一氧化碳來還原。1834年,李比希即通過金屬鉀和一氧化碳反應得到了乙炔二醇鉀K2C2O2 [3]。
但是長久以來該產物被認為是「羰基鉀」"KCO。其後的130年中,下列物質的乙炔二醇鹽都被錯認為"羰基"化合物:鈉(Johannis, 1893)、鋇(Gunz and Mentrel, 1903)、鍶(Roederer, 1906)、和鋰、銣和銫(Pearson, 1933)。
[4]。
而這個反應最終被證明其當時合成的是乙炔醇鉀K
2C
2O
2和苯六酚鉀K
6C
6O
6。
[5]這些鹽的真正結構是由Werner Büchner 和E. Weiss於1963年證實的。
[6][7]
此外,乙炔醇鹽現在還可以通過這樣的條件製備:快速的將一氧化碳和相應的金屬在液氨中形成的溶液反應。[4] 乙炔醇鉀是一種黃白色的固體,其和空氣、鹵素、鹵代烴、醇、水(以及其他具有酸性氫官能團的物質)都反應很劇烈而容易爆炸。[8]
配位化合物[編輯]
乙炔二醇可以形成配位化合物,比如[TaH(HOC≡COH)(dmpe)2Cl]+Cl−,其中的dmpe指1,2-雙(二甲基瞵)乙烷。[9]
乙炔二醇和相關的陰離子比如三角酸鹽C
3O2−
3和方酸鹽C
4O2−
4都已經通過一氧化碳在溫和條件下和CO配體在有機鈾化合物的催化下偶聯還原得到。[10]
其他衍生物[編輯]
雖然說除了二醇以外的衍生物非常少,還是有諸如((CH3)2CH)-O-C≡C-O-(CH(CH3)2) 和((CH3)3C)-O-C≡C-O-(C(CH3)3)的衍生物。 [11]
參見[編輯]
參考文獻[編輯]
- ^ Johan K. Terlouw, Peter C. Burgers, Ben L. M. van Baar, Thomas Weiske, and Helmut Schwarz (1986), The Formation in the Gas Phase of HO-CC-OH, H2N-CC-NH2, H2N-CC-OH and related Compounds by Selective Reduction of their Cations, Chimia, volume 40, page 357–359. Online version (頁面存檔備份,存於網際網路檔案館) accessed on 2009-08-01.
- ^ Günther Maier, Christine Rohr (1995), Ethynediol: Photochemical generation and matrix-spectroscopic identification. Liebigs Annalen, Volume 1996 Issue 3, Pages 307–309. doi:10.1002/jlac.15719960304 Abstract[永久失效連結]
- ^ Justus Liebig (1834), Annalen der Chemie und Pharmacie, volume 11, p. 182. Cited by Raymond N. Vrtis et al (1988), JACS p. 7564.
- ^ 4.0 4.1 T. G. Pearson (1933), Carbonyls of Lithium, Rubidium and Caesium. Nature, volume 131, pp. 166–167 (04 February 1933). doi:10.1038/131166b0
- ^ Werner Büchner, E. Weiss (1964) Zur Kenntnis der sogenannten «Alkalicarbonyle» IV[1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid. Helvetica Chimica Acta, Volume 47 Issue 6, Pages 1415–1423.doi:10.1002/hlca.19640470604
- ^ Werner Büchner, E. Weiss (1963) Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK. Helvetica Chimica Acta, Volume 46 Issue 4, Pages 1121–1127. doi:10.1002/hlca.19630460404
- ^ E. Weiss, Werner Büchner (1963), Zur Kenntnis der sogenannten Alkalicarbonyle. II. Die Kristallstrukturen des Rubidium- und Caesium-acetylendiolats, RbOC≡CORb und CsOC≡COCs. Zeitschrift für anorganische und allgemeine Chemie, Volume 330 Issue 5-6, Pages 251–258. doi:10.1002/zaac.19643300504
- ^ Charles Kenneth Taylor (1982), The Chemical Behavior of the Alkali Metal Acetylenediolates. Thesis, Pennsylvania State University; also Technical Memo A642321, Penn State University Park Applied Research Lab. 227 pages.
- ^ Raymond N. Vrtis, Ch. Pulla Rao, Simon G. Bott, and Stephen J. Lippard (1988), Synthesis and Stabilization of Tantalum-Coordinated Dihydroxyacetylene from Two Reductively Coupled Carbon Monoxide Ligands J. Am. Chem. Soc., volume 110 issue 22, pp 7564–7566. doi:10.1021/ja00230a062
- ^ Alistair S. Frey, F. Geoffrey N. Cloke, Peter B. Hitchcock (2008), Mechanistic Studies on the Reductive Cyclooligomerisation of CO by U(III) Mixed Sandwich Complexes; the Molecular Structure of [(U(η-C8H6{Si'Pr3-1,4}2)(η-Cp*)]2(μ-η1:η1-C2O2) Journal of the American Chemical Society, volume 130, issue 42, pages 13816–13817. doi:10.1021/ja8059792
- ^ Anna Bou, Miquel A. Pericàs and Félix Serratosa (1981), Diisopropoxy- and di-tert-butoxyethyne : Stable acetylene diethers. Tetrahedron, Volume 37, Issue 7, Pages 1441-1449. doi:10.1016/S0040-4020(01)92464-0
