四氟化锡
外观
| 四氟化锡 | |
|---|---|
| |
| IUPAC名 tin(IV) fluoride | |
| 别名 | 氟化锡 氟化锡(IV) |
| 识别 | |
| CAS号 | 7783-62-2 |
| PubChem | 134654 |
| SMILES |
|
| InChI |
|
| EINECS | 232-016-0 |
| 性质 | |
| 化学式 | SnF4 |
| 摩尔质量 | 194.704 g·mol⁻¹ |
| 外观 | 白色固体 |
| 密度 | 4.78 g/cm3[1] |
| 熔点 | 705 °C(升华)[1] |
| 结构 | |
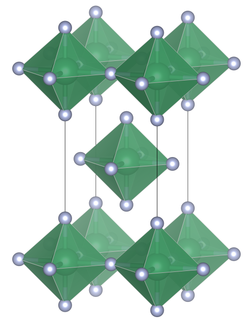
| 晶体结构 | 四方晶系,tI10 |
| 空间群 | I4/mmm, No. 139 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
四氟化锡是一种无机化合物,化学式为SnF4。它是白色固体,熔点超过700℃。[2]
制备
[编辑]- Sn + 2F2 → SnF4
但是,生成的氟化物膜会覆盖在锡的表面使反应趋缓至停止。无水氢氟酸和四氯化锡的反应可以克服这一缺点:[2]
- SnCl4 + 4HF → SnF4 + 4HCl
性质
[编辑]碱金属氟化物与之反应,可以得到六氟合锡(IV)酸盐(如K2SnF6),其中包含八面体的SnF62−阴离子。SnF4作为路易斯酸,可以和一些分子加成为形式L2·SnF4或L·SnF4的化合物。[3]
四氟化锡在高温下可以被锡还原为氟化亚锡,被碱金属甚至是铁,还原为单质锡。[4]
二氧化氮和四氟化锡在室温之上反应,可以得到硝酸三氟化锡(IV)和六氟(IV)合锡酸亚硝酰:[4]
- 3 SnF4 + 4 NO2 → 2 SnF3(NO3) + (NO)2SnF6
参考文献
[编辑]- ^ 1.0 1.1 hrsg. von Georg Brauer. Unter Mitarb. von M. Baudler. Handbuch der präparativen anorganischen Chemie / 1.. Stuttgart: Enke. 1975: 232. ISBN 3-432-02328-6. OCLC 310719485 (德语).
- ^ 2.0 2.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997: 381. ISBN 0-7506-3365-4.
- ^ 3.0 3.1 Holleman, A. F.; Wiberg, E.; Wiberg, N. Inorganic Chemistry, 1st Edition. Academic Press. 2001: 908. ISBN 0-12-352651-5.
- ^ 4.0 4.1 无机化学丛书 第三卷 碳 硅 锗分族. 北京:科学出版社, 1998. pp 413
