劳氏肉瘤病毒
| 劳氏肉瘤病毒 | |
|---|---|

| |
| 病毒分类 | |
| (未分级): | 病毒 Virus |
| 域: | 核糖病毒域 Riboviria |
| 界: | 副核糖病毒界 Pararnavirae |
| 门: | 逆转录酶病毒门 Artverviricota |
| 纲: | 逆转录酶病毒纲 Revtraviricetes |
| 目: | 逆转录病毒目 Ortervirales |
| 科: | 逆转录病毒科 Retroviridae |
| 属: | α反转录病毒属 Alpharetrovirus |
| 种: | 劳氏肉瘤病毒 Rous sarcoma virus
|
劳氏肉瘤病毒 (Rous sarcoma virus,RSV[1])是一种逆转录病毒,并且是首种被发现的肿瘤病毒,会在鸡中引起肉瘤。与所有逆转录病毒一样,它将其RNA基因组逆转录成cDNA,然后再整合到宿主DNA中。
历史
[编辑]在1911年,任职于洛克菲勒大学的裴顿·劳斯进行了一项实验,他将患有肉瘤的鸡的无细胞萃取物注入健康的鸡体内,结果发现这种萃取物能够引起癌变,这就是人类首次发现劳氏肉瘤病毒的过程。这种由萃取物引起的肿瘤是由结缔组织(一种肉瘤)所组成。[2][3] 因此,RSV被认为是第一种可以用来研究癌症分子发展的致癌逆转录病毒。[4]
1958年,哈利·鲁宾和霍华德·马丁·特明开发了一种新的检测方法,该方法可透过感染RSV改变鸡胚成纤维细胞的形态。到了1960年,霍华德·特明得出结论一个重要的结论,即细胞的转化形态是由RSV的一种遗传特性所控制的。[注 1]接着,霍华德·特明等人又发现了两个重要的事实:在分离出来的病毒中,复制能力强的病毒与RSV相关,却没有转化能力;但另一株复制缺陷型的RSV菌株则具有转化能力。这两个发现得出了RSV中病毒复制和恶性转化是两个独立的概念。[5]
由于发现了劳氏肉瘤病毒的重要性,裴顿·劳斯于1966年获得诺贝尔生理学或医学奖。[6] 随后,其它科学家亦陆续发现如人类疱疹病毒第四型等的人类致癌病毒。[4]
结构与基因体
[编辑]| 逆转录病毒3'-UTR稳定元件 | |
|---|---|
| |
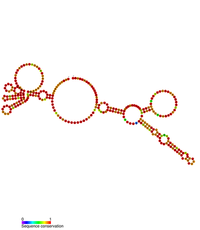
| 劳氏肉瘤病毒逆转录病毒3'-UTR稳定元件的预测二级结构 | |
| 识别符 | |
| 代号 | ? |
| Rfam | RF01417 |
| 其他数据 | |
| RNA类型 | 顺式作用元件 |
RSV是一种属于第六组的含套膜病毒,其基因体为正链RNA,并在生命周期中产生DNA中间体。
具自由复制能力的RSV通常具有下列四个基因:[7]
然而,不是所有RSV菌株都具有所有四个基因。因此,并非所有的RSV菌株都能既自我复制又引起转化。目前尚不清楚RSV的原始菌株是否具有自我复制的能力,或者是否有些后代菌株后来获得了这种能力。[8] 大部分急性肿瘤或转化的逆转录病毒不能在没有辅助病毒的情况下复制,这也使RSV的非缺陷菌株相当独特。[9]
RSV基因体具有长末端重复序列,使其能够整合到宿主基因体中,并且过度表达RSV基因。
Src基因
[编辑]src基因是癌基因,可触发异常宿主细胞的无限生长。它是第一个被发现的逆转录病毒肿瘤基因。[10] 它是一种后天获得的基因,在整个动物界中都存在,并在不同物种间具有高度的保守性。
v-Src基因赋予病毒能够刺激宿主细胞的无控制有丝分裂,为新感染提供充足的细胞。[12]尽管src基因对RSV的繁殖并非必要,但当它存在时,会大幅增加致病力。[10]
Src是一种参与调节细胞生长和分化的酪氨酸激酶,具有SH2和SH3区域,这些区域负责其激活和抑制。[5]
RNA二级结构
[编辑]RSV的RNA基因体包含一个极长的3'-UTR,长度在5000—7000碱基对之间,通常会将其引导至真核宿主细胞内的无义介导的mRNA降解(NMD)。在3'-UTR内已经确定了一个保守的二级结构元件,被称为劳氏肉瘤病毒稳定性元件(英语:Rous Sarcoma Virus Stability Element,RSE)。[13] 此元件已经被证明可以防止未剪接的病毒之RNA降解。[13]
RSE元件最初是在RSV的基因体中被发现的,但似乎在整个鸟类逆转录病毒家族中高度保守。RSE元件长度约为300碱基对,位于gag自然翻译终止密码子的下游。RSE元件的二级结构已经透过RNAse降解和SHAPE分析确定。[14]
此外,RSV中还确定了其他的元件,其中包括一引物结合位。[15]
Gag蛋白
[编辑]对于病毒粒子的组装以及成熟病毒感染宿主细胞的过程来说,gag蛋白扮演着关键的角色。RSV的gag蛋白(Pr76)包含701个氨基酸。此蛋白被病毒编码的蛋白酶切割,并释放出在感染性病毒粒子中可以找到的产物。这些切割产物包括底物(MA)、衣壳(CA)和核壳(NC),能够进入其他途径来感染新的细胞。[16][17]
RSV套膜
[编辑]RSV具有一个包含一种糖蛋白的套膜:env。Env由gp85和gp37组成,这些糖蛋白能够组装成寡聚体,其功能是将RSV与宿主细胞受体结合并以不受pH值影响的方式诱导与目标细胞的融合。套膜则是在胞吐作用期间获得的,病毒在细胞质膜上形成突出部,使其能够带着来自宿主细胞的新外膜离开细胞。[16][18]
复制周期
[编辑]进入细胞
[编辑]RSV透过胞吞作用或与宿主细胞膜的融合进入宿主细胞。[19]
转录
[编辑]RSV基因组的转录,需要4S RNA作为RSV的引物,而70S RNA则作为DNA合成的模板,并再透过RNA复制酶,将病毒RNA转录成全长的DNA互补股。[20]
注释
[编辑]- ^ 后来确定系由“src”基因负责健康细胞的形态转化
参考资料
[编辑]- ^ 存档副本. [2024-01-25]. (原始内容存档于2024-05-10).
- ^ Rous P. A Transmissible Avian Neoplasm (Sarcoma of the Common Fowl). J. Exp. Med. 1910-09, 12 (5): 696–705. PMC 2124810
 . PMID 19867354. doi:10.1084/jem.12.5.696.
. PMID 19867354. doi:10.1084/jem.12.5.696.
- ^ Rous P. A Sarcoma of the Fowl Transmissible by an Agent Separable from the Tumor Cells. J. Exp. Med. 1911-04, 13 (4): 397–411. PMC 2124874
 . PMID 19867421. doi:10.1084/jem.13.4.397.
. PMID 19867421. doi:10.1084/jem.13.4.397.
- ^ 4.0 4.1 Weiss RA, Vogt PK. 100 years of Rous sarcoma virus. J. Exp. Med. 2011-11, 208 (12): 2351–5. PMC 3256973
 . PMID 22110182. doi:10.1084/jem.20112160.
. PMID 22110182. doi:10.1084/jem.20112160.
- ^ 5.0 5.1 Martin GS. The hunting of the Src. Nat. Rev. Mol. Cell Biol. 2001-06, 2 (6): 467–75. PMID 11389470. S2CID 205016442. doi:10.1038/35073094.
- ^ The Nobel Prize in Physiology or Medicine 1966. NobelPrize.org. [2024-01-17]. (原始内容存档于2020-05-23) (英语).
- ^ Rous sarcoma virus - Prague C, complete genome. 2016-07-26 [2024-01-18]. (原始内容存档于2024-06-04).
- ^ Yatsula, B. A.; Geryk, J.; Briestanska, J.; Karakoz, I.; Svoboda, J.; Rynditch, A. V.; Calothy, G.; Dezelee, P. Origin and evolution of the c-src-transducing avian sarcoma virus PR2257. Journal of General Virology. 1994-10-01, 75 (10): 2777–2781. PMID 7931166. doi:10.1099/0022-1317-75-10-2777
 .
. The replication competent strains of Rous sarcoma virus (RSV) are exceptional in that they contain a complete set of replicative genes in addition to the transduced oncogene sequences. In this respect, they differ markedly from all other acutely transforming retroviruses, in which a large part of the replicative genes have been lost during transduction of cellular proto-oncogenes. However, since both the Bryan strain of RSV (Lerner & Hanafusa, 1984) and RSV29 (Dutta et al., 1985), the closest isolate to the original Rous tumour virus, lack the env gene, it is likely that the ancestral virus was also replication defective.
– See Vogt PK (2019) for discussion of whether PR2257 constitutes a de novo uptake. - ^ Vogt, PK. The Importance of Being Non-Defective: A Mini Review Dedicated to the Memory of Jan Svoboda.. Viruses. 2019-01-18, 11 (1). PMC 6360021
 . PMID 30669277. doi:10.3390/v11010080
. PMID 30669277. doi:10.3390/v11010080  .
.
- ^ 10.0 10.1 Vogt PK. Retroviral oncogenes: a historical primer. Nat. Rev. Cancer. 2012-09, 12 (9): 639–48. PMC 3428493
 . PMID 22898541. doi:10.1038/nrc3320.
. PMID 22898541. doi:10.1038/nrc3320.
- ^ Swanstrom, R; Parker, R C; Varmus, H E; Bishop, J M. Transduction of a cellular oncogene: the genesis of Rous sarcoma virus.. Proceedings of the National Academy of Sciences. 1983-05, 80 (9): 2519–2523. PMC 393857
 . PMID 6302692. doi:10.1073/pnas.80.9.2519
. PMID 6302692. doi:10.1073/pnas.80.9.2519  .
.
- ^ Wyke, AW; Frame, MC; Gillespie, DA; Chudleigh, A; Wyke, JA. Mitogenesis by v-Src: fluctuations throughout G1 of classical immediate early AP-1 and mitogen-activated protein kinase responses that parallel the need for the oncoprotein.. Cell growth & differentiation : the molecular biology journal of the American Association for Cancer Research. 1995-10, 6 (10): 1225–34. PMID 8845299.
- ^ 13.0 13.1 Weil JE, Beemon KL. A 3' UTR sequence stabilizes termination codons in the unspliced RNA of Rous sarcoma virus. RNA. 2006-01, 12 (1): 102–10. PMC 1370890
 . PMID 16301601. doi:10.1261/rna.2129806.
. PMID 16301601. doi:10.1261/rna.2129806.
- ^ Weil JE, Hadjithomas M, Beemon KL. Structural characterization of the Rous sarcoma virus RNA stability element. J. Virol. 2009-03, 83 (5): 2119–29. PMC 2643715
 . PMID 19091866. doi:10.1128/JVI.02113-08.
. PMID 19091866. doi:10.1128/JVI.02113-08.
- ^ Johnson M, Morris S, Chen A, Stavnezer E, Leis J. Selection of functional mutations in the U5-IR stem and loop regions of the Rous sarcoma virus genome. BMC Biol. 2004, 2: 8. PMC 428589
 . PMID 15153244. doi:10.1186/1741-7007-2-8
. PMID 15153244. doi:10.1186/1741-7007-2-8  .
.
- ^ 16.0 16.1 Wills JW, Cameron CE, Wilson CB, Xiang Y, Bennett RP, Leis J. An assembly domain of the Rous sarcoma virus Gag protein required late in budding. J. Virol. 1994-10, 68 (10): 6605–18. PMC 237081
 . PMID 8083996. doi:10.1128/JVI.68.10.6605-6618.1994.
. PMID 8083996. doi:10.1128/JVI.68.10.6605-6618.1994.
- ^ Nadaraia-Hoke S, Bann DV, Lochmann TL, Gudleski-O'Regan N, Parent LJ. Alterations in the MA and NC domains modulate phosphoinositide-dependent plasma membrane localization of the Rous sarcoma virus Gag protein. J. Virol. 2013-03, 87 (6): 3609–15. PMC 3592118
 . PMID 23325682. doi:10.1128/JVI.03059-12.
. PMID 23325682. doi:10.1128/JVI.03059-12.
- ^ Einfeld D, Hunter E. Oligomeric structure of a prototype retrovirus glycoprotein. Proc. Natl. Acad. Sci. U.S.A. 1988-11, 85 (22): 8688–92. Bibcode:1988PNAS...85.8688E. PMC 282525
 . PMID 2847170. doi:10.1073/pnas.85.22.8688
. PMID 2847170. doi:10.1073/pnas.85.22.8688  .
.
- ^ Gilbert JM, Mason D, White JM. Fusion of Rous sarcoma virus with host cells does not require exposure to low pH. J. Virol. 1990-10, 64 (10): 5106–13. PMC 248002
 . PMID 2168989. doi:10.1128/JVI.64.10.5106-5113.1990.
. PMID 2168989. doi:10.1128/JVI.64.10.5106-5113.1990.
- ^ Dahlberg JE, Sawyer RC, Taylor JM, Faras AJ, Levinson WE, Goodman HM, Bishop JM. Transcription of DNA from the 70S RNA of Rous sarcoma virus. I. Identification of a specific 4S RNA which serves as primer. J. Virol. 1974-05, 13 (5): 1126–33. PMC 355423
 . PMID 4132919. doi:10.1128/JVI.13.5.1126-1133.1974.
. PMID 4132919. doi:10.1128/JVI.13.5.1126-1133.1974.
